
 Fe(OH)2+Ni(OH)2,
Fe(OH)2+Ni(OH)2,| A.只有③ | B.③④ | C.④⑤ | D.①②⑤ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锂离子电池已成为笔记本电脑、移动电话等低功耗电器的主流电源 |
| B.氢氧燃料电池可将化学反应的热能直接转变为电能 |
| C.铅蓄电池放电时铅在负极被氧化成二氧化铅 |
| D.锌锰干电池工作一段时间后碳棒变细 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
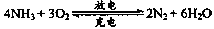
| A.氨燃料电池在放电时,氨气被氧化 |
| B.氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH- |
| C.以氨气代替氢气的主要原因是:氨气易液化易储存 |
| D.燃料电池的能量转化率一般比普通的电池高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在使用的过程中,电池负极区溶液的碱性减弱 |
| B.在使用的过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Zn极是正极,Ag2O是负极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
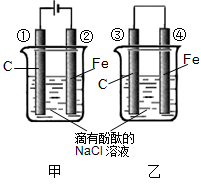
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Li2NH中N的化合价为-1 |
| B.此法储氢和钢瓶储氢的原理相同 |
| C.LiH中的阳离子半径大于阴离子半径 |
| D.该反应中H2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
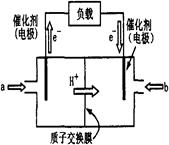
 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。 +b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。
+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com