
| A. | $\frac{25a{V}_{0}{V}_{2}}{W{V}_{1}}$% | B. | $\frac{25a{V}_{1}{V}_{2}}{W{V}_{0}}$% | C. | $\frac{25a{V}_{1}{V}_{0}}{W{V}_{2}}$% | D. | $\frac{25a{V}_{2}}{W}$% |
分析 根据Ca原子、草酸根离子守恒得5CaCO3~5CaC2O4~5H2C2O4~2MnO4-,根据碳酸钙和高锰酸根离子之间的关系式计算.
解答 解:根据Ca原子、草酸根离子守恒得5CaCO3~5CaC2O4~5H2C2O4~2MnO4-,
设高锰酸钾溶液消耗的碳酸钙的物质的量为x,
5CaCO3~5CaC2O4~5H2C2O4~2MnO4-,
5 2
x (a×V2×10-3)mol
5:2=x:(a×V2×10-3)mol
x=$\frac{a×{V}_{2}×1{0}^{-3}×5}{2}$mol=2.5aV2×10-3mol
则V0mL溶液中n(CaCO3)=$\frac{2.5a{V}_{2}×1{0}^{-3}}{{V}_{1}×1{0}^{-3}}×{V}_{0}$×10-3mol=$\frac{2.5a{V}_{0}{V}_{2}×1{0}^{-3}}{{V}_{1}}$mol,
其质量分数=$\frac{\frac{2.5a{V}_{0}{V}_{2}×1{0}^{-3}}{{V}_{1}}×100}{W}×100%$=$\frac{25a{V}_{0}{V}_{2}}{W{V}_{1}}$%,
故选A.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析判断及计算能力,明确各个物理量之间的关系式是解本题关键,注意单位换算.


科目:高中化学 来源: 题型:选择题
| A. | 硒(Se)化氢比硫化氢稳定 | B. | 钫(Fr)与水反应比钾与水反应剧烈 | ||
| C. | 铍(Be)的原子失电子能力比镁弱 | D. | 氢氧化锶(Sr)比氢氧化钙的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
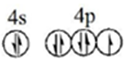 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
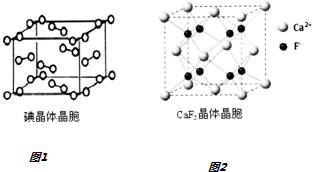
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和甲醇 | B. | 丙醛和丙酮 | C. | 乙烯和乙炔 | D. | 乙烯和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
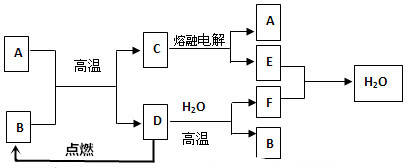
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
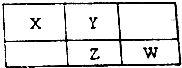
| A. | 原子半径Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W | |
| C. | 四种元素的单质中,Z单质的熔、沸点最高 | |
| D. | Z的单质与足量的单质Y反应,直接得到一种ZY3的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,NH4Cl溶液加水稀释过程中,$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$数值增大 | |
| B. | O.lOOOmol•L-1 的醋酸钠溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000mol•L-1 | |
| C. | 室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,则Ka1(H2CO3)×Ka2(H2CO3)<K | |
| D. | 室温,Ka(CH3COOH)=l.76×l0-5,Kb(NH3•H2O)=1.76×lO-5.则CH3COONH4溶液中存在:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-)>c(NH3•H2O)=c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com