
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去):
![]()
下列说法不正确的是
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是盐酸,则X与Z可反应生成Y
C.若X是FeCl3溶液,则W可以是Zn或Al
D.若W是硝酸溶液, 则X与Z不能反应生成Y
科目:高中化学 来源: 题型:
【题目】水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:
C(s)+H2O(g)![]() CO(g)+H2(g)△H=+131.3kJmol-1
CO(g)+H2(g)△H=+131.3kJmol-1
(1)该反应的化学平衡常数表达式K= ,若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),H2O(g)的平衡转化率为
(2)对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
(3)上述反应达到平衡后,移走体系中部分C(s),平衡 ,将产生的CO全部移走,平衡 (以上两空选填“向左移”、“向右移”、“不移动”)。
(4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
增大容器体积(用实线表示) ②升高温度(用虚线表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
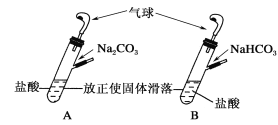
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol·L-1
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol·L-1
D.最终两试管中Na+、Cl-的物质的量一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如图所示
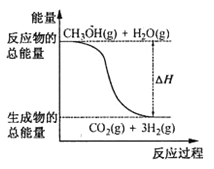
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素是指每种质量不到体重的万分之一,质量总和不到人体质量的千分之一的近二十种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素不是微量元素的是( )
A.I B.H C.Zn D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应中,平衡常数与反应进行的限度关系正确的是( )
A.K越大,反应程度越大 B.K越大,反应程度越小
C.K的大小与反应程度无关 D.升高温度,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度,实验时将样品放置于D中。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
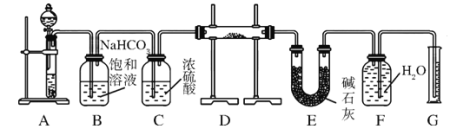
回答下列问题:
(1)装置A中液体试剂选用 。
(2)装置B的作用是 。装置C的作用是 。
装置E中碱石灰的作用是 。
(3)装置D中发生反应的化学方程式是 、 。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列常见物质的俗名与化学式对应正确的是
A. 小苏打— NaHCO3 B. 铁红— Fe3O4
C. 熟石灰— CaO D. 明矾— CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又知:H2O(l)=H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH=____________。
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________。
CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________。
A.v(H2)正=2v(CO)逆 B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变 D.CH3OCH3和H2O的体积之比不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g)![]() CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
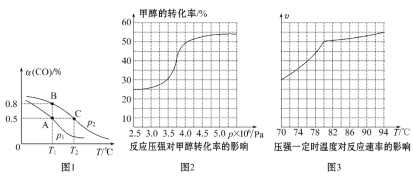
①合成甲醇的反应为______________(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为____________________。p1和p2的大小关系为___________。
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________L。
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH2=-29.1 kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
HCOOCH3(g) ΔH2=-29.1 kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________(填“3.5×106Pa”“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com