
向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)= v(A),反应2 min时,A的浓度减少了
v(A),反应2 min时,A的浓度减少了 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成,回答下列问题:
mol,有a mol D生成,回答下列问题:
(1)反应2 min内v(A)=________,v(B)=________
(2)化学方程式中,x=__________,y=__________,p=________,q=________
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH________0(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”、“减小”或“不变”),理由是________。
②平衡时反应物的转化率________(填“增大”“减小”或“不变”),理由是________。
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:填空题
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
(1)检查图1所示装置气密性的方法是____________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量__________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
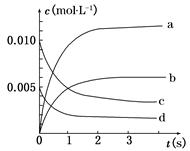
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)  3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是 (用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比 (选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C mol。
(4)在同一容器中加nmolA和3n molB,则平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m间变化,那么,n与m的关系是_____________。(用字母n、m关系式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废水中常含有一定量的Cr2O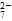 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为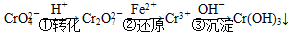
其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O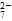 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O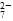 和CrO
和CrO 的浓度相同
的浓度相同
b.2v(Cr2O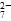 )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O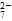 离子,需要______mol的FeSO4·7H2O。
离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O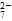 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为______________________________________
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________________,溶液中同时生成的沉淀还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知可逆反应:A(g)+B(g)  C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)=a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol/L,达到平衡后c(D)= 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如下图所示,由图中数据分析得: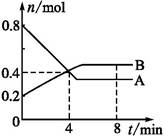
(1)在4 min末时,A、B的物质的量浓度c(A) c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题: (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com