
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 加热碳酸氢钠固体时,试管管口倾斜向上 | |
| C. | 实验室制取氯气时,用NaOH溶液进行尾气吸收 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
分析 A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应;
B.碳酸氢钠分解生成水;
C.NaOH溶液能与碱反应;
D.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性.
解答 解:A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故A错误;
B.碳酸氢钠分解生成水,则用试管加热碳酸氢钠固体时使试管口略向下倾斜,故B错误;
C.NaOH溶液能与碱反应,可吸收尾气,故C正确;
D.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性,则浓硫酸溅到皮肤上时立即用抹布擦拭,再水冲洗,最后涂上适量的碳酸氢钠溶液,故D错误;
故选C.
点评 本题考查化学与生活、实验安全,把握物质的性质、实验基本技能、实验安全常识等为解答的关键,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
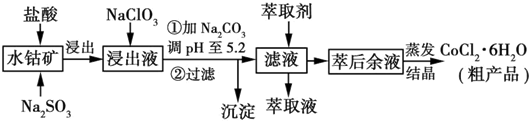
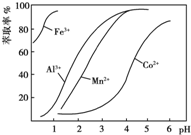
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向次氯酸溶液中滴加NaOH溶液:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2、NO、O2 | B. | 肯定没有C12、O2和NO2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性的强弱 | |
| B. | 最高价氧化物对应的水化物酸性的强弱 | |
| C. | 单质沸点的高低 | |
| D. | 单质与氢气化合的难易 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com