
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
物质导电的条件:存在自由电子或者自由移动的离子;
单质和混合物既不是电解质也不是非电解质;
解答 解:①液态HCl在水溶液中能导电是化合物,属于电解质; 不含自由电子或者自由移动的离子,不导电;
②熔融NaCl在水溶液中或熔融状态下能导电的化合物,属于电解质;含自由移动的离子,导电;
③稀硫酸为混合物,既不是电解质也不是非电解质;含有自由移动离子,能导电;
④蔗糖在水溶液中和熔融状态下不能导电的化合物,属于非电解质;不含自由电子或者自由移动的离子,不导电;
⑤乙醇在水溶液中和熔融状态下不能导电的化合物,属于非电解质;不含自由电子或者自由移动的离子,不导电;
⑥氯水是混合物,既不是电解质也不是非电解质;含有自由移动离子,能导电;
⑦Al2O3熔融状态下能导电的化合物,属于电解质;不含自由电子或者自由移动的离子,不导电;
⑧NH3本身不能电离出自由移动离子而导电,属于非电解质;不含自由电子或者自由移动的离子,不导电;
⑨氨水是混合物,既不是电解质也不是非电解质;含有自由移动离子,能导电;
⑩Cu是单质,既不是电解质也不是非电解质;含有自由电子,能导电;
⑪CaCO3熔融状态下能导电的化合物,属于电解质;不含自由电子或者自由移动的离子,不导电;
⑫SO2本身不能电离出自由移动离子而导电,属于非电解质;不含自由电子或者自由移动的离子,不导电;
⑬Al(OH)3熔融状态下能导电的化合物,属于电解质;不含自由电子或者自由移动的离子,不导电;
⑭NaOH在水溶液中或熔融状态下能导电的化合物,属于电解质;不含自由电子或者自由移动的离子,不导电;
⑮CH3COOH在水溶液中能导电的化合物,属于电解质;不含自由电子或者自由移动的离子,不导电;
所以:属于电解质的是①②⑦⑪⑬⑭⑮;属于非电解质的是④⑤⑧⑫;能导电的是②③⑥⑨⑩;既不是电解质又不是费电解质的是③⑥⑨⑩.
故答案为:①②⑦⑪⑬⑭⑮;④⑤⑧⑫;②③⑥⑨⑩;③⑥⑨⑩.
点评 本题考查了电解质、非电解质的判断,熟悉基本概念是解题关键,注意电解质、非电解质都是化合物,单质、混合物既不是电解质也不是非电解质,注意电解质必须本身能够电离,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与锌粒反应:Cu2++Zn=Zn2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LNO与1.12L O2混合后的分子数小于0.1NA | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未冷却就转移、定容 | B. | 容量瓶原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 量筒取浓盐酸时,俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
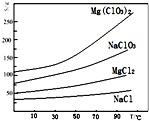 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com