
| 0.1mol |
| 0.15L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
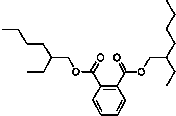 受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )
受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )| A、DEHP是芳香族化合物 |
| B、DEHP是酯类物质 |
| C、DEHP分子中共有5个双键 |
| D、DEHP分子中至少有8个碳原子在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、22.3mL |
| B、22.30mL |
| C、23.65mL |
| D、23.4 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
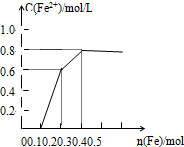 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强p(Pa) | 2×105 | 5×105 | 1×106 |
| c(A)mol/L | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度有利于该反应平衡正向移动 |
| D、达到平衡后,减小压强有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高纯度的单质硅被广泛用于制作计算机芯片、制造太阳能电池 |
| B、硅可由二氧化硅还原制得 |
| C、常温时硅与水、空气和酸不反应,但能与氢氟酸反应 |
| D、自然界硅元素的贮量丰富,并存在大量的单质硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com