
【题目】在一定体积容器中发生反应:2CH4(g)+2NH3(g)+3O2(g)=2HCN(g)+6H2O(g),15分钟内测得反应速率用HCN表示为v(HCN)=0.36 mol/(L·min),该段时间内下列表示正确的是( )
A.15分钟内反应消耗氨气5.4 mol
B.该时间内可用水表示反应速率为v(H2O)=1.08 mol/(L·min)
C.各物质的速率关系有:2v(CH4)=2v(NH3)=3v(O2)
D.15分钟内氧气浓度下降8.1 mol/L
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及其化合物在生活和生产中有很重要的用途。
(1)氨是合成硝酸、铵盐和氮肥的基本原料。在一定条件下用氮气和氢气合成氨气,然后再用氨氧化法制取硝酸。在整个生产过程中,氮气的利用率为85%。写出氨氧化法制取硝酸的反应式____________现有0.2t液态氮,能生产出浓度为40%的硝酸______________千克。
(2)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2 g。
①Cu与Cu2O的物质的量之比?____________
②硝酸的物质的量浓度?___________
(3)将30mLNO和O2混合气体通入过量NaOH溶液中,充分反应后,溶液中只含两种溶质(不考虑水解),且剩余气体体积为2mL。求原混合气体中NO和O2体积比?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E的合成路线如图:

已知:
①
②
完成下列填空:
(1)B中官能团的名称为_____.C2H4生成C2H5Br的反应类型为____.
(2)C的分子式为_____.
(3)检验C2H5Br分子中含有溴原子的实验方案为____.
(4)E的结构简式为![]() ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
(5)写出一种满足下列条件的有机物的结构简式_____
①分子式只比E少2个氢原子
②与FeCl3发生显色反应
③分子中含有4种不同化学环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究SO2和氯水的漂白性,设计了如下实验,装置如图.完成下列填空:
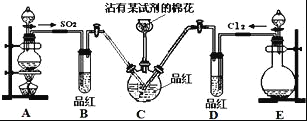
(1)棉花上沾有的试剂是NaOH溶液,作用是______.
(2)①反应开始一段时间后,B、D两个试管中可以观察到的现象分别是:B:_____,D:____.
②停止通气后,分别加热B、D两个试管,可以观察到的现象分别是:B:_____,D:____.
(3)有同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不理想.产生该现象的原因(用化学方程式表示)______.
(4)装置E中用_____(填化学式)和浓盐酸反应制得Cl2,生成2.24L(标准状况)的Cl2,则被氧化的HCl为____mol.
(5)实验结束后,检验蘸有试剂的棉花含有SO42﹣的实验方案是:取棉花中的液体少许,滴加足量的稀HNO3,再加入几滴BaCl2溶液,出现白色沉淀.该方案是否合理____,理由是___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年居里夫妇用α粒子轰击![]() 得到一种自然界不存在的核素
得到一种自然界不存在的核素![]() ,开创了人造核素的先河。其发生的变化如下:
,开创了人造核素的先河。其发生的变化如下:![]() +
+![]() →
→![]() +
+![]() 。下列有关说法错误的是
。下列有关说法错误的是
A.![]() 和
和![]() 两种原子互为同位素
两种原子互为同位素
B.在![]() 中,质子数=中子数=核外电子数
中,质子数=中子数=核外电子数
C.该变化同样遵循质量守恒定律
D.该变化说明原子核在化学反应中也能发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3可作食用碱。下列方程式中正确的是( )
A.Na2O2与CO2反应生成Na2CO3:Na2O2 +CO2=Na2CO3+O2
B.Na2CO3溶液呈碱性:CO32-+H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.NaHCO3可作发酵粉:2NaHCO3![]() Na2CO3+CO2↑ +H2O
Na2CO3+CO2↑ +H2O
D.Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D. =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com