
【题目】氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:
(1)已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1025kJmol﹣1
②N2(g)+O2(g)2NO(g)△H=+180.5kJmol﹣1水的汽化热△H=+44kJmol﹣1据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式____________________________________________________________;
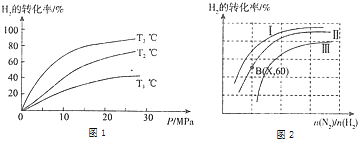
(2)工业时合成氨的原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 。图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为___ , 曲线与曲线对应的压强P1___P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=______________________。
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=___(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
下列各项中能说明反应已达到平衡状态的是_____________________ 。
a.混合气体的平均相对分子质量不变
b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变
d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3 , 其总反应是8NO+7H2═3NH4NO3+2HNO3 , 试写出以惰性材料作电极的阴极反应式:___ . 电解过程中为使电解产物全部转化为NH4NO3 , 需要补充NH3的原因是___ 。
【答案】2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1650kJ/mol T1>T2>T3 > 1:2 ![]() a NO+6H++5e﹣=NH4+ +3H2O 总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3
a NO+6H++5e﹣=NH4+ +3H2O 总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3
【解析】
(1)已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=﹣1025kJmol﹣1
②N2(g)+O2(g)2NO(g) △H=+180.5kJmol﹣1
水的汽化热△H=+44kJmol﹣1,则可得:③H2O(l)=H2O(g)△H=+44kJmol﹣1,
根据盖斯定律,②×2+③×6﹣①可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g);
(2)正反应为放热反应,温度越高,氢气的转化率越低;
正反应为气体物质的量减小的反应,压强越大,氢气的转化率越大;
测得B(X,60)点时N2的转化率为40%,则:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol): a b
变化量(mol):0.4a 1.2a
根据氢气的转化率可得![]() 100%=60%,即b=2a,可以计算起始投料比[n(N2)/n(H2)];
100%=60%,即b=2a,可以计算起始投料比[n(N2)/n(H2)];
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,二者按1:3反应,故平衡时二者物质的量分数之比为1:3,平衡时NH3的物质的量分数为20%,则N2的物质的量分数为![]() ×(1﹣20%)=20%,H2的物质的量分数为1﹣20%﹣20%=60%,再计算各物质的分压,代入Kp=
×(1﹣20%)=20%,H2的物质的量分数为1﹣20%﹣20%=60%,再计算各物质的分压,代入Kp=![]() 计算;
计算;
a.混合气体总质量不变,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,混合气体的平均相对分子质量不变,说明反应到达平衡;
b.平衡时NH3的生成速率等于N2的消耗速率的2倍;
c.混合气体总质量不变、容器的容积不变,密度为常数;
d.N2和H2的起始物质的量之比等于化学计量数之比,二者物质的量之比始终为1:3;
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3 ,其总反应是:8NO+7H2═3NH4NO3+2HNO3 ,阴极发生还原反应,阴极上是NO获得电子生成NH4+,由电荷守恒可知有H+参与反应,还生成水,电池总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3。
(1)已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=﹣1025kJmol﹣1
②N2(g)+O2(g)2NO(g) △H=+180.5kJmol﹣1
水的汽化热△H=+44kJmol﹣1,则可得:③H2O(l)=H2O(g)△H=+44kJmol﹣1,
根据盖斯定律,②×2+③×6﹣①可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) 的△H=+1650kJ/mol,
故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=+1650kJ/mol;
(2)正反应为放热反应,温度越高,氢气的转化率越低,则T1>T2>T3;
正反应为气体物质的量减小的反应,压强越大,氢气的转化率越大,则:P1>P2;
测得B(X,60)点时N2的转化率为40%,则:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol): a b
变化量(mol):0.4a 1.2a
根据氢气的转化率可得![]() 100%=60%,即b=2a,则X=
100%=60%,即b=2a,则X=![]() =
=![]() =1:2,
=1:2,
故答案为:T1>T2>T3 ;> ;1:2;
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,二者按1:3反应,故平衡时二者物质的量分数之比为1:3,平衡时NH3的物质的量分数为20%,则N2的物质的量分数为![]() ×(1﹣20%)=20%,H2的物质的量分数为1﹣20%﹣20%=60%,平衡时容器总压为aMPa,则Kp=
×(1﹣20%)=20%,H2的物质的量分数为1﹣20%﹣20%=60%,平衡时容器总压为aMPa,则Kp=![]() =
=![]() ;
;
a.混合气体总质量不变,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,混合气体的平均相对分子质量不变,说明反应到达平衡,故a正确;
b.平衡时NH3的生成速率等于N2的消耗速率的2倍,故b错误;
c.混合气体总质量不变、容器的容积不变,密度始终不变,故c错误;
d.N2和H2的起始物质的量之比等于化学计量数之比,二者物质的量之比始终为1:3,故d错误。
故答案为:![]() ;a;
;a;
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3 ,其总反应是:8NO+7H2═3NH4NO3+2HNO3 ,阴极发生还原反应,阴极上是NO获得电子生成NH4+,由电荷守恒可知有H+参与反应,还生成水,电池总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3。
故答案为:NO+6H++5e﹣=NH4++3H2O;总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3。


科目:高中化学 来源: 题型:
【题目】胆矾![]() 是一种重要的含铜化合物,某课外研究小组用粗铜(含少量
是一种重要的含铜化合物,某课外研究小组用粗铜(含少量![]() )通过不同的化学反应制取胆矾的过程如图:
)通过不同的化学反应制取胆矾的过程如图:

物质 | 完全沉淀时的pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
当溶液中被沉淀离子的物质的量浓度小于![]() 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
试回答下列问题:
(1)下列物质中,最适合作为试剂X的是________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)由粗铜通过两种途径制取胆矾,与途径Ⅱ相比,途径Ⅰ有明显的两个优点,分别是______________、____________________。
(3)试剂Y可以是______________________(任填一种物质的化学式)。
(4)若溶液C中![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() ,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
(5)氢化亚铜![]() 是一种红色固体,40~50℃时,滤液E和
是一种红色固体,40~50℃时,滤液E和![]() 溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5
溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5![]() 个电子,生成CuH的物质的量为________mol。
个电子,生成CuH的物质的量为________mol。
(/span>6)纳米氧化亚铜![]() 是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成
是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成![]() 的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
(7)得到![]() 晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.

(1)写出实验室制取乙炔的化学方程式: ______.
(2)实验室制取乙炔时,分液漏斗中的液体 a通常是 ______.
(3)B溶液的作用是 ______.
(4)装置D中的现象是: ______.
(5)乙炔能否使溴的的四氯化碳溶液褪色?______(“能”或“不能”),若能写出完全反应原理_______________
(6)工业上常用乙炔、氯化氢等物质作原料来合成聚氯乙烯,请写出相关方程式 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法不正确的是
A. 1mol O2与金属钠反应,O2不一定得到4NA个电子
B. 标准状况下,a L CH4和a L C6H14中所含分子数均为![]()
C. 常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子
D. 在20℃、1atm时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,分别进行不同条件下的合成氨反应N2(g)+3H2(g)![]() 2NH3(g)。在相同时间内表示该反应速率最快的是
2NH3(g)。在相同时间内表示该反应速率最快的是
A. v(H2)=0.1mol/(Ls) B. v(N2)=0.1mol/(Ls) C. v(N2)=0.2mol/(Ls) D. v(NH3)=0.3mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
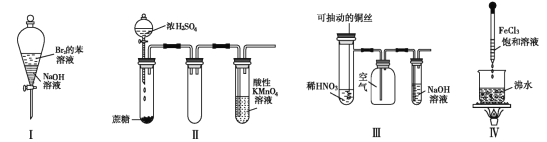
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:
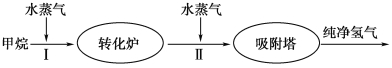
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)此流程的第Ⅱ步反应CO(g)+H2O(g) ![]() H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是________(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v(CO2正)=v(H2O逆)
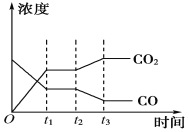
(4)下图表示此流程的第Ⅱ步反应在t1时刻达到平衡,在t2时刻分别因改变某个条件而发生变化的情况:图中t2时刻发生改变的条件可能是________________________(写出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是
A. 用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
B. 用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O
C. 将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+
D. 向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com