
| A.混合物中Cu的物质的量为0.2 mol |
| B.产生的NO在标准状况下的体积为4.48L |
| C.硝酸的物质的量浓度为2.6mol/L |
| D.Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol |
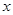 mol,则Cu的物质的量为
mol,则Cu的物质的量为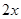 mol,则可得等式:
mol,则可得等式: ,解得
,解得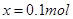 ,则
,则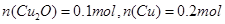 。故选项A正确。
。故选项A正确。 ,则可得关系式:
,则可得关系式: ,解得
,解得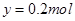 ,因此其在标准状态下的体积
,因此其在标准状态下的体积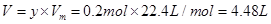 。因此选项B正确。
。因此选项B正确。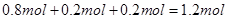 ,其浓度
,其浓度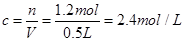 ,故选项C说法错误。
,故选项C说法错误。 

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

| A.点①所示溶液中: c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中: c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.点③所示溶液中: c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.V3>V2>V1 | B.V3=V2=V1 | C.V1=V2>V3 | D.V3>V2=V1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。
水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过沉淀反应,可以使溶液中某种离子的浓度变为0 |
| B.反应NH3+H3O+ |
| C.若测得雨水的pH小于7,则下的是酸雨 |
| D.先将pH试纸用蒸馏水润湿后,再测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.CH3COOH+NaCN===CH3COONa+HCN |
| B.CO2+H2O+2NaClO===Na2CO3+2HClO |
| C.2HCN+Na2CO3―→2NaCN+CO2+H2O |
| D.Na2CO3+C6H5OH―→NaHCO3+C6H5ONa |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 将 (填“增大”、 “减小”或“不变”);
将 (填“增大”、 “减小”或“不变”);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com