
| A. | 向NaHSO3溶液中加入NaHSO4溶液:HSO${\;}_{3}^{-}$+H+═H2O+SO2↑ | |
| B. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
分析 A.反应生成水、二氧化硫、硫酸钠;
B.反应生成硝酸铁,溶液为黄色;
C.反应生成硫酸钡和水,符合离子的配比及电荷守恒;
D.反应生成氢氧化铝和氯化铵.
解答 解:A.向NaHSO3溶液中加入NaHSO4溶液的离子反应为HSO3-+H+═H2O+SO2↑,故A正确;
B.铁溶于稀硝酸,溶液变黄的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,故B错误;
C.Ba(OH)2与H2SO4两稀溶液混合的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C正确;
D.AlCl3溶液中加入过量氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | “胃舒平”是治疗胃酸过多的药物 | |
| B. | “阿司匹林”是解热镇痛和消炎的药物 | |
| C. | “创可贴”是小伤口的外用消炎药物 | |
| D. | “风油精”是包治百病的药物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用98%、1.84g/mL的浓硫酸配制1mol/L、500mL的稀硫酸时,应用量筒量取浓硫酸约27.17mL | |
| B. | 从碘水中萃取碘,如果没有四氯化碳和苯,其实也可以用酒精代替 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液蒸干 | |
| D. | 从石蜡油中取用金属钠,发现取量过多,为了不浪费,又把过量的金属钠放回试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 其他条件不变,T2温度下反应到1000s时N2O5(g)浓度为2.98mol•L-1,则T1<T2 | |
| B. | T1温度下的平衡常数值为K1=125,1000s时转化率为50% | |
| C. | 500s内N2O5分解速率为2.96×10-3 mol•L-1•s-1 | |
| D. | 该反应△S>0,虽然是吸热反应,在常温下也能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )| A. | 如用此种电池电镀铜,待镀铜金属上增重19.2g,则至少消耗标准状况下2.24L CH4 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
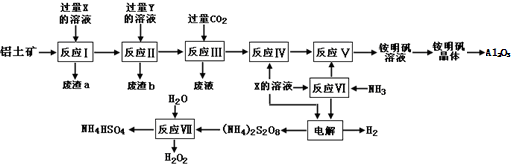
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | L层上的电子数为奇数的原子一定是主族元素的原子 | |
| B. | 核电站泄漏的放射性物质131I和127I互为同位素,化学性质相似 | |
| C. | 化学键的形成一定伴随着电子的转移和能量变化 | |
| D. | 元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com