
| A. | 少量金属钠保存在煤油里 | |
| B. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| C. | 为防止氧化,FeSO4溶液存放在加有少量铜粉的试剂瓶中 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
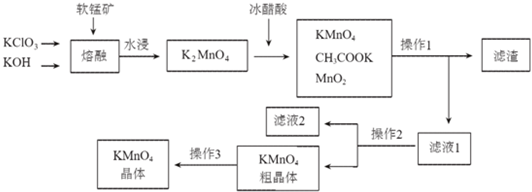
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
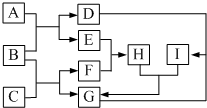 有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1.
有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
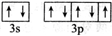
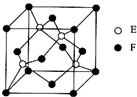 A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| D | 原子L电子层上有2对成对电子 |
| E | E与D同主族 |
| F | 基态F+核外有3层电子且各层均处于全满状态 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
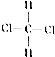 和
和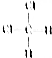 ⑧乙烷和戊烷
⑧乙烷和戊烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
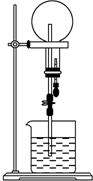 已知NH3和HCl都是能用来做喷泉实验的气体.若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示.喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑烧瓶内溶质的扩散,氨水的溶质按NH3计算)( )
已知NH3和HCl都是能用来做喷泉实验的气体.若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示.喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑烧瓶内溶质的扩散,氨水的溶质按NH3计算)( )| A. | 溶质的物质的量浓度相同、溶质的质量分数不同 | |
| B. | 溶质的质量分数相同、溶质的物质的量浓度不同 | |
| C. | 溶质的物质的量浓度和溶质的质量分数都不同 | |
| D. | 溶质的物质的量浓度和溶质的质量分数都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
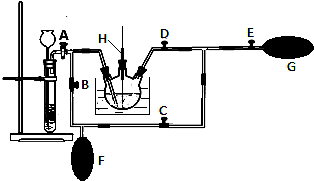
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com