
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 液氯贮存在干燥的钢瓶里 | |
| B. | 少量的锂、钠、钾均保存在煤油中 | |
| C. | 浓溴水保存在带橡皮塞的棕色细口瓶中 | |
| D. | 用排水法收集满一瓶氢气,用玻璃片盖住瓶口,瓶口朝上放置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
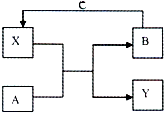 A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )| A. | 若X是光导纤维的主要成分,工业上常利用反应I制备B,Y的化学式为CO | |
| B. | 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为Fe3O4+8H++2I-=3Fe 2++I2+4H2O | |
| C. | 若组成A的元素在短周期中原子半径最大(稀有气体除外),以Y为电解质溶液,气体B为燃料,C为氧化剂可构成燃料电池,工作一段时间后,Y溶液的pH增大 | |
| D. | 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应X检验氯气管道是否漏气,Y的电子式为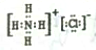 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2LO2和03组成的混合气体含有原子数为NA | |
| B. | 常温常压下,1.7gNH3含有的电子数目为NA | |
| C. | .0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA | |
| D. | 标准状况下,22.4LNO2与足量的H2O充分反应后转移电子数为NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照甲烷与氯气的混合物;乙烯使酸性高锰酸 钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴人浓硝酸和浓硫酸的混合液中水浴加热; 乙烯与水蒸气在一定条件下反应生成乙醇 | |
| D. | 在苯中滴人溴水,溴水褪色;乙烯使溴水褪色. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
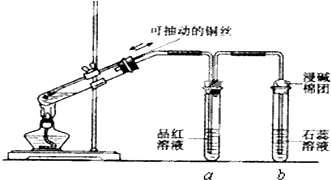
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com