
| A.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| B.稀有气体形成的晶体属于分子晶体 |
| C.干冰升华时,分子内共价键会发生断裂 |
| D.金属晶体的熔点普遍都很高 |
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:不详 题型:单选题
| A.C2H4在氧气中充分燃烧生成的CO2与H2O的物质的量之比 |
| B.K2S溶液中c(K+)与c(S2-)之比 |
| C.Na2O2晶体中阳离子与阴离子的物质的量之比 |
| D.16O原子的中子数和质量数之比 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| a | | | | | |||||||||||||
| | | | | b | c | d | | | |||||||||
| | | | | | e | f | | | |||||||||
| | | | | | g | | h | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
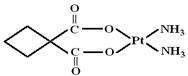
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.金刚石和石墨的熔点肯定要比C60高 |
| B.熔点比较:C60<C70<C90 |
| C.球碳分子、管状碳分子、洋葱状碳分子都是分子晶体,都是碳的同素异形体 |
| D.金刚石、石墨晶体属原子晶体;C60、C70、管状碳分子和洋葱状碳分子均属分子晶体。两类不是同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C60气化和金刚石熔化克服的作用力相同 |
| B.甲酸甲酯的熔点低于乙酸的熔点 |
| C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 |
| D.分子晶体的熔沸点低,常温下均呈液态或气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com