
| A. | 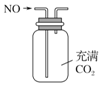 用图所示装置(正放)可收集NO气体 | |
| B. | 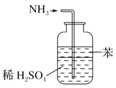 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 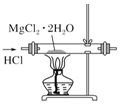 用装置制取无水MgCl2 | |
| D. | 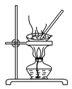 用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
分析 A.NO的密度比二氧化碳小,导管应该采用短进长出的方式;
B.氨气直接与稀硫酸接触,无法防止倒吸;
C.在HCl气流中可以抑制镁离子的水解;
D.氯化铵不稳定,加热分解生成氨气和HCl.
解答 解:A.一氧化氮的密度小于二氧化碳,应该采用向下排空气法收集,导管应该采用短进长出的方式,图示装置无法达到实验目的,故A错误;
B.氨气极易溶于水,吸收氨气时需要防倒吸,由于苯的密度小于水,图示装置无法起到防倒吸作用,可用四氯化碳,故B错误;
C.镁离子水解生成氢氧化镁和HCl,HCl能够抑制镁离子的水解,所以在HCl气流中加热氯化镁晶体可以制取无水MgCl2,故C正确;
D.氯化铵加热分解,用图示蒸干NH4Cl饱和溶液的方法无法获取NH4Cl晶体,故D错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度中等,涉及尾气吸收、盐的水解原理、气体收集等知识,明确常见元素及其化合物性质为解答关键,试题有利于培养学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
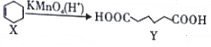 ,下列说法错误的是( )
,下列说法错误的是( )| A. | X分子中所有碳原子一定在同一平面上 | |
| B. | X与乙烯不属于同系物 | |
| C. | Y可发生取代反应、氧化反应 | |
| D. | Y的含有相同官能团的同分异构体有8种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
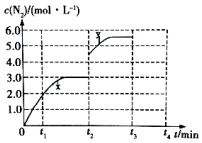 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为除去酸性CuCl2溶液中含有的少量Fe3+,可在加热、搅拌的条件下加入氨水,过滤后,再向滤液中加入适量盐酸 | |
| B. | 在工业合成NH3的反应中,采取高温措施 | |
| C. | 恒温下,对平衡体系H2(g)+Br2(g)?2HBr(g)加压,可使气体颜色变深 | |
| D. | 向饱和氯化钠溶液中不断缓慢地通入HCl气体,会析出晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 →-N=
→-N= ;
;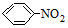 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$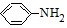 (易被氧化).请回答:
(易被氧化).请回答: ;
;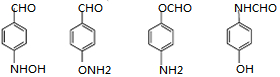 ;
;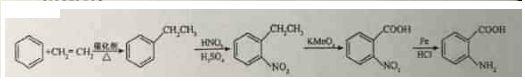 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| D. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com