
| A. | Fe | B. | Zn | C. | Mg | D. | Al |
分析 稀硫酸浓度降低,说明金属与稀硫酸反应生成氢气,令金属的相对原子质量为a、反应中化合价为b,消耗一半硫酸时金属有剩余,根据电子转移守恒列不等式,结合选项讨论确定.
解答 解:参加反应的硫酸物质的量=0.1L×2mol/L×$\frac{1}{2}$=0.1mol,令金属的相对原子质量为a、反应后化合价为b,金属还没有全部溶解,根据电子转移守,则$\frac{6}{a}$×b>0.1×2,
A.反应中Fe为+2价,则a<$\frac{6×2}{0.2}$=60,故A符合;
B.反应中Zn为+2价,则应a<$\frac{6×2}{0.2}$=60,而锌的相对原子质量为65,故B不符合;
C.反应后Mg为+2价,则a<$\frac{6×2}{0.2}$=60,故C符合;
D.反应后Al为+3价,则a<$\frac{6×3}{0.2}$=90,故D符合;
故选B.
点评 本题考查根据方程式计算、氧化还原反应计算,难度不大,注意利用电子转移守恒方法简化计算,转移讨论法的利用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸馏 | B. | 升华 | C. | 浸取 | D. | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 油脂为高分子化合物 | |
| D. | 符合分子式C5H12的物质有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
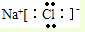 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2→2H2O+285.75KJ | B. | 2H2(g)+O2 (g)→2H2O(l)+571.5KJ | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)→H2O(g)+285.75KJ | D. | H2(g)+$\frac{1}{2}$O2(g)→H2O(l)-285.75KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 离子的核间距 | 23.1nm | 31.8nm | 21.0nm |
| A. | ①>②>③ | B. | ③>②>① | C. | ③>①>② | D. | ②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种溶液pH的大小顺序是③>②>① | |
| B. | 若将三种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若三种溶液的pH均为11,则物质的量浓度的大小顺序是③>①>② | |
| D. | 若分别加入25mL等物质的量浓度的盐酸后,pH最大的是① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| B. | 氢氧化钠溶液中通入过量的二氧化硫:SO2+OH-=HSO3- | |
| C. | 碳酸氢钙溶液中加足量的氢氧化钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 稀硫酸和氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com