
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下: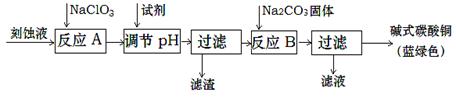
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |

(1)①将Fe2+氧化成Fe3+并最终除去②3.2-4.2③取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净④ 反应B的温度过高
(2)①分液漏斗 ②不能证明 因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白
2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
③Cl2 HClO ClO- 有无色气体产生 (1分 )
解析试题分析:(1)该化学工艺流程的目的用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜。必须除去废液Fe2+、Fe3+,结合题给数据分析,需先将Fe2+氧化为Fe3+才能与Cu2+分离开。由题给流程图分析,刻蚀废液加入氯酸钠经反应A将Fe2+氧化为Fe3+,结合题给数据知加入试剂调节pH至3.2-4.2,Fe3+转化为氢氧化铁沉淀经过滤除去,滤液中加入碳酸钠经反应B生成碱式碳酸铜,过滤得产品。①由上述分析知,氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;②反应A后调节溶液的pH的目的是将铁离子转化为氢氧化铁沉淀而除去,pH范围应为3.2-4.2;③第一次过滤得到的产品为氢氧化铁,表面含有氯离子等杂质离子。洗涤时,判断已经洗净的方法是取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净;④碱式碳酸铜受热分解生成氧化铜,造成蓝绿色产品中混有CuO杂质的原因是反应B的温度过高。(2)① 实验室用二氧化锰和浓盐酸加热制取氯气为固液加热制气体的装置,所用仪器需要检漏的有分液漏斗;② 若C中品红溶液褪色,不能证明氯气与水反应的产物有漂白性,原因是 因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;C中品红溶液褪色,说明装置B中氯气已过量,此时B装置中亚铁离子和溴离子均已被氧化,发生反应的离子方程式是2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 ;③ 氯气与水反应生成盐酸和次氯酸,该反应为可逆反应,次氯酸为弱酸,则A溶液中具有强氧化性微粒的化学式Cl2 HClO ClO- ;若向A溶液中加入NaHCO3粉末,盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,会观察到的现象是有无色气体产生。
考点:以化学工艺流程为载体考查物质的分离提纯等实验基本操作,考查氯气的制备和性质。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:填空题
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。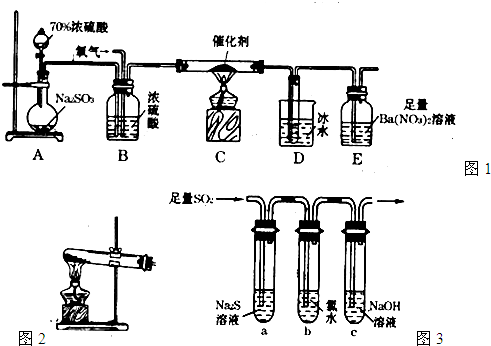
(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校课外小组的学生,利用排饱和食盐水的方法收集了一平底烧瓶的氯气,同时制备了一平底烧瓶的饱和氯水,探究完成以下性质实验。请按照要求完成下列问题:
(1)按如图安装好实验装置,U形管内盛有有色墨水,A、B两端液面相平,平底烧瓶盛满氯气。通过分液漏斗向平底烧瓶中滴加少量氢氧化钠溶液,观察到实验现象是 、 。请简单解释原因 。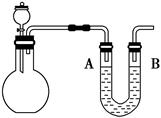
(2)如图所示,平底烧瓶盛满饱和氯水,当日光照射到盛有饱和氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是 ;当氯水中不再产生气泡时,某学生欲检验该反应所产生的气体,该同学可采取的合理操作是 。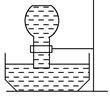
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: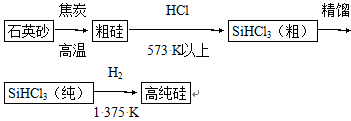
①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式____________________;H2还原SiHCl3过程中若混有O2,可能引起的后果是____________________。
(2)下列有关硅材料的说法正确的是 ( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡。写出实验现象并给予解释(用化学方程式说明)_________________________ ____。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是________(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅及其化合物对人类现代文明的发展具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
| A.①②⑤ | B.③④⑤ | C.②③④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上采用生石灰和含硫的煤混合使用以“固硫”(避免硫的化合物进入大气),最后生成石膏。试回答:
(1)整个“固硫”反应所涉及的反应类型包括:①化合反应②分解反应 ③置换反应 ④复分解反应 ⑤氧化还原反应 ⑥非氧化还原反应 ⑦离子反应 ⑧非离子反应(分子反应)。其中正确的是( )。
A.①⑤⑥⑦ B.①②③⑤⑧ C.①⑤⑥⑧ D.②④⑤⑦
(2)第一步“固硫”反应的化学方程式中所需气态物质的化学计量数为( )
A.1 B.2 C.3 D.4
(3)比较此法与石灰石粉末与含硫煤混合法哪个更好些________(A.生石灰 B.石灰石),原因是________。
(4)你认为减少酸雨产生可采取的措施是( )。
①少用煤作燃料 ②把工厂的烟囱造高 ③先将燃料煤脱硫 ④在土壤中加石灰防止酸化 ⑤开发新能源,避免含S、N的氧化物大量排放
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用图所示装置收集以下4种气体(图中烧瓶的位置不得变化)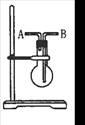
①NO ②Cl2 ③NH3 ④SO2 (写序号)
(1)若烧瓶是干燥的,则由B口进气收集的气体有________;
(2)若烧瓶是干燥的,则由A口进气,可收集的气体有_______。
(3)若烧瓶充满水,可收集的气体有________,这时气体由________进入。
(4)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有_____ ___,这时气体由________口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下: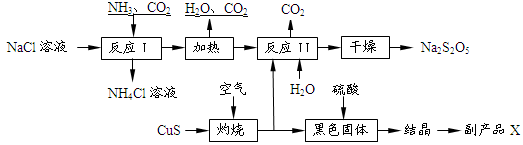
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)反应I的化学方程式为: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是 。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾;②品红溶液;③澄清石灰水;④饱和碳酸氢钠溶液;⑤NaOH;⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是氮元素的各种价态与物质类别的对应关系: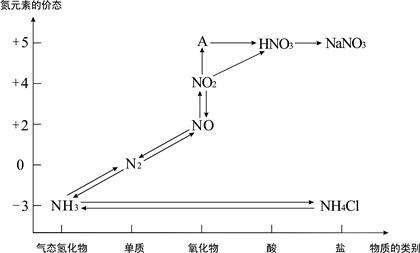
(1)根据A对应的化合价和物质类别,A的摩尔质量是 ,从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有 。
(2)实验室依据复分解反应原理制取NH3的化学方程式是 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应使 。
(4)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为 。
(5)合成法制硝酸是以NH3为原料,经催化氧化后再用水吸收来实现的,若开始时投入17吨NH3,最后生产出的硝酸为42吨,则硝酸的产率是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com