
| A. | H2F+的电子式: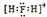 | |
| B. | 铝原子的结构示意图: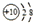 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | K2CO3水解的离子方程式:CO32-+2H2O?H2CO3+2OH- |
分析 A.H2F+为阳离子,所有原子都需要标出最外层电子;
B.铝原子的核电荷数为13,不是10,最外层为3个电子;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.碳酸根离子的水解分步进行,主要以第一步为主.
解答 解:A.H2F+为阳离子,H、F原子需要标出最外层电子,其电子式为: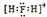 ,故A正确;
,故A正确;
B.铝原子的核电荷数=核外电子总数=13,其原子结构示意图为: ,故B错误;
,故B错误;
C.质子数为35、中子数为45的溴原子质量数为80,该核素正确的表示方法为:3580Br,故C错误;
D.碳酸钾水解实质为碳酸根离子水解,碳酸根离子的水解需要分步进行,主要以第一步为主,其正确的离子方程式:CO32-+H2O?HCO3-+OH-,故D错误;
故选A.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及原子结构示意图、电子式、元素符号、离子方程式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生规范答题的能力.


科目:高中化学 来源: 题型:解答题
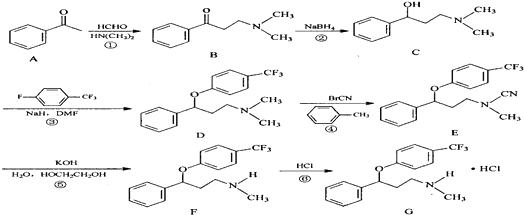

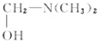 .
.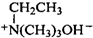 $\stackrel{△}{→}$CH2=CH2;请写出以
$\stackrel{△}{→}$CH2=CH2;请写出以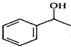 、HCHO、HN(CH3)2为有机原料,合成
、HCHO、HN(CH3)2为有机原料,合成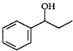 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将水垢置于盛食醋的试管中 | 有气泡产生 | 醋酸的酸性比碳酸强 |
| B | 用湿润的蓝色试纸检验某气体 | 试纸变红 | 气体是酸性氧化物 |
| C | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | NaHCO3不溶于水 |
| D | 向酚酞溶液中加少量Na2O2 | 溶液变红 | Na2O2是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu$\stackrel{空气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu+AgNO3→Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1molNH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
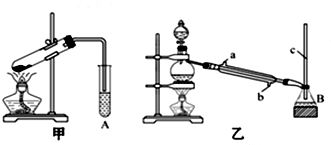
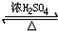 HCO18OCH3+H2O.
HCO18OCH3+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com