

| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |


 ŠĀæĪ±źĶ¬²½ŃµĮ·ĻµĮŠ“š°ø
ŠĀæĪ±źĶ¬²½ŃµĮ·ĻµĮŠ“š°ø Ņ»ĻßĆūŹ¦æŚĖćÓ¦ÓĆĢāĢģĢģĮ·Ņ»±¾Č«ĻµĮŠ“š°ø
Ņ»ĻßĆūŹ¦æŚĖćÓ¦ÓĆĢāĢģĢģĮ·Ņ»±¾Č«ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
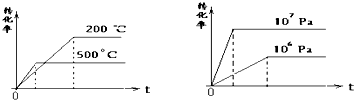
²éæ““š°øŗĶ½āĪö>>
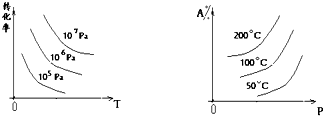
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®øĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦ |
| B£®bµćŹ±»ģŗĻĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæ²»ŌŁ±ä»Æ |
| C£®T1ĪĀ¶ČĻĀaµć±ķŹ¾ČōĻė“ļµ½Ę½ŗā£¬æÉŅŌ²ÉČ”Ōö“óŃ¹ĒæµÄ·½·Ø |
| D£®cµćæɱķŹ¾v£ØÕż£©£¼v£ØÄę£© |
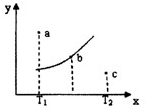
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£®a£ŗb£ŗc=m£ŗn£ŗp | B£®a£ŗb=m£ŗn£¬
| ||||||||||
C£®
| D£®a=
|
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā

| n(SO3) |
| n(SO2) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
| ĢåĻµ | c£ØSO2£©mol/L | c£ØO2£©mol/L | c£ØSO3£©mol/L | ·“Ó¦·½Ļņ |
| £Ø1£© | 0.0600 | 0.400 | 2.00 | |
| £Ø2£© | 0.0960 | 0.300 | 0.500 | |
| £Ø3£© | 0.300 | 0.0400 | 1.44 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
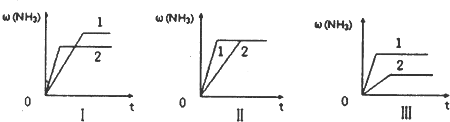
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com