
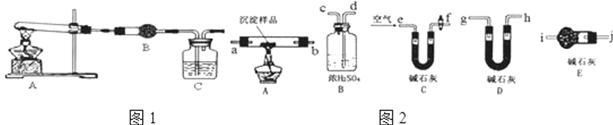
分析 Ⅰ.(1)沉淀是CuCO3说明,Na2CO3溶液与CuSO4溶液发生反应生成硫酸钠与碳酸铜,据此书写反应的离子方程式;
Ⅱ.根据氢氧化铜加热分解生成水的性质选择检验试剂,
(3)装置B检验是否有水生成,可用无水硫酸铜固体检验;
(4)用澄清的石灰水检验是否产生二氧化碳;
Ⅲ.(5)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收;
(6)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收;
(7)根据质量的增加值计算碳酸铜和氢氧化铜的质量,
解答 解:Ⅰ.(1)沉淀是CuCO3说明,Na2CO3溶液与CuSO4溶液发生反应生成硫酸钠与碳酸铜,即碳酸根与铜离子反应生成碳酸铜沉淀,反应离子方程式为CO32-+Cu2+=CuCO3↓,
故答案为:CO32-+Cu2+=CuCO3↓;
Ⅱ.(3)装置B检验是否有水生成,可用无水硫酸铜固体检验,若无水硫酸铜变蓝色说明有水生成,验证沉淀中有氢氧化铜生成,否则沉淀中无氢氧化铜,
故答案为:无水硫酸铜固体;
(4)用澄清的石灰水检验是否产生二氧化碳,装置C中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3,
故答案为:装置C中澄清石灰水变浑浊;
Ⅲ.(5)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为e→f→a→b→d→c→g→h→j,
故答案为:a→b→d→c→g→h;
(6)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气,由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置B,开始时通入处理过的空气可以将装置中原有的H2O 蒸汽和CO2排出,反应结束后,为防止空气的中二氧化碳和水蒸气被吸收,应在装置的后面连接盛有碱石灰的干燥管,
故答案为:吸收空气中的H2O 蒸汽和CO2;结束时通入处理过的空气可以将装置中滞留的H2O 蒸汽和CO2赶出;
(7)若沉淀样品的质量为m克,装置B质量增加了n克,应为水的质量,发生:Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O,
Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O
98g 18g
m(Cu(OH)2) ng
m(Cu(OH)2)=$\frac{98n}{18}$g,
m(CuCO3)=mg-$\frac{98n}{18}$g,
ω(CuCO3)=$\frac{mg-\frac{98n}{18}g}{mg}$=1-$\frac{49n}{9m}$,
则沉淀中CuCO3的质量分数为1-$\frac{49n}{9m}$,
故答案为:1-$\frac{49n}{9m}$.
点评 本题考查化学反应机理的探究,题目难度中等,本题注意根据物质的化学性质设计实验方案,实验时要排除空气中水和二氧化碳的干扰.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L氯仿(CHCl3)含0.4NA个共价键 | |
| B. | 1molNaHSO4固体含3NA个离子 | |
| C. | NA个H2分子与NA个I2(g)分子反应生成HI(g),反应后容器中含2NA个分子 | |
| D. | 反应:K35ClO3+6H37Cl═3Cl2↑+KCl+3H2O,当有71gCl2生成时,转移0.5NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


 .
. +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.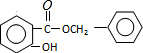 .
.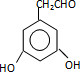 (或
(或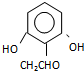 )(任写一种即可)
)(任写一种即可) 
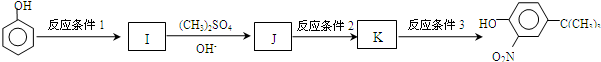
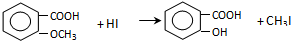
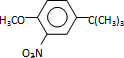 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学设计了如图的实验:
某同学设计了如图的实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH-(5:2:4:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | D. | K+、H+、I-、NO3-(1:1:1:1) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
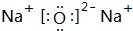 .MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.
.MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

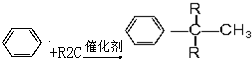 (R为烷基)
(R为烷基) ;E中含有的官能团名称是羟基和醛基;
;E中含有的官能团名称是羟基和醛基; $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;该反应类型为消去反应;
+H2O;该反应类型为消去反应; +CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$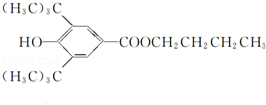 +H2O;该反应类型为酯化反应;
+H2O;该反应类型为酯化反应;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的单质在通常情况下呈气态 | B. | R的单质可能是一种无色的固体 | ||
| C. | R的氢化物稳定 | D. | 单质R与H2的化合反应非常困难 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com