
��16�֣���֪�ϳɰ��ķ�ӦΪ3H2��g��+N2��g�� 2NH3��g�� ��H��0����ij�ܱ������в��ʵ�����ݼ����ݴ������±���
2NH3��g�� ��H��0����ij�ܱ������в��ʵ�����ݼ����ݴ������±���
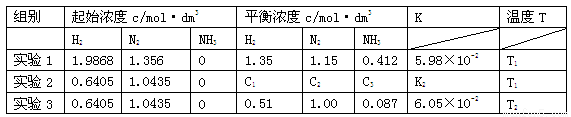
��1������˵������˵���ϳɰ���Ӧ�ﵽƽ�����
A������ʱ�������������ܶȲ���
B����ѹʱ��������ƽ����Է�����������
C��1 mol N��N�����ѵ�ͬʱ����3mol H-H������
��2���������¶�ʱ��ƽ���� �����ƶ�(��������桱)���뻭����t2ʱ�����º��v-tͼ����������Ҫ�ı�ע��

��3������ʵ��2��K2= ���¶�T1��T2�Ĵ�С��ϵ�� �����жϵ������� ��
��1��B ��3�֣�
��2���� ��3�֣�
 ����4�֣�
����4�֣�
��3��K= 5.98��10-2 ��2�֣� T1 �� T2 ��2�֣���
��ƽ�ⳣ��ֻ���¶��йأ�ʵ��1��ʵ��2���¶���ͬ������K��ͬ����ƽ�ⳣ�����ƽ��������Ӧ�����ƶ�����Ϊ�÷�ӦΪ���ȷ�Ӧ�������¶Ȳ���ʹƽ��������Ӧ�����ƶ�����2�֣�
(ÿ��2�֣���6��)
��������
�����������1��A���ϳɰ������в��뷴Ӧ�����ʾ�Ϊ���壬����ʱ��������������������������䣬������䣬���ܶ�ʼ�ձ��ֲ��䣬A����B����ѹʱ�����뷴Ӧ���������������䣬ƽ����Է�������������������ʵ��������ȣ���ƽ����Է����������ֲ���ʱ�������뷴Ӧ����������ʵ�����������ˣ���Ӧ�ﵽƽ��״̬��B��ȷ��C�����ݷ�Ӧ����ʽ��֪�����ܷ�Ӧ��û�ﵽƽ�1 mol N��N�����ѵ�ͬʱ������3mol H-H�����ѣ�C����ΪB����2���ϳɰ�����ӦΪ���ȷ�Ӧ���������¶�ʱ��ƽ�������ȷ�Ӧ�ķ����ƶ�������ƽ�����淴Ӧ�����ƶ��������¶ȣ����淴Ӧ���ʶ������淴Ӧ��������ı������࣬���ŷ�Ӧ�Ľ��У��淴Ӧ������С������Ӧ����������������淴Ӧ��������ȣ����½����µ�ƽ�⣬�ҷ�Ӧ���ʱ�ԭƽ������ʴ�ͼ�����Ա�ʾΪ��

��3����ƽ�ⳣ��ֻ���¶��йأ�����ʵ��1��ʵ��2���¶���ͬ������K��ͬ����K= 5.98��10-2�������ñ���ʵ��1��ʵ��3��֪��ʵ��3��ƽ�ⳣ�����ƽ��������Ӧ�����ƶ�����Ϊ�÷�ӦΪ���ȷ�Ӧ�������¶Ȳ���ʹƽ��������Ӧ�����ƶ���
���㣺���鿼�黯ѧƽ��ԭ������ѧƽ�ⳣ����Ӧ�ü�ͼ������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ������ | ������ |
| A | ��ͬ������NaHCO3���ܽ�ȱ�Na2CO3��С | ��Na2CO3��Һ��ͨ������CO2����Һ����� |
| B | �Ʊ�ͭ���� | �����ƿɴ�����ͭ��Һ���û���ͭ���� |
| C | ����������Ũ���ᡢŨ���������Ӧ | �������۳��ܷ�����Ũ���ᡢŨ���� |
| D | �ϳɰ���ӦΪ���ȷ�Ӧ | �÷�Ӧ���ڸ��������½��� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡտ���и�����һ���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣���450�沢�д��������£������Ϊ1L���ܱպ��������У���������������������·�Ӧ��2SO2+ O2 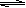 2SO3
2SO3
��1����֪��64g SO2��ȫת��ΪSO3��ų�85kJ������SO2ת��ΪSO3���Ȼ�ѧ����ʽ�� ��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK= ��
��3�������¶ȣ���ѧ��Ӧ���� ���÷�ӦKֵ�� ���������С�����䡱��
��4��450��ʱ����һ�ܱ������У�������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ����Ӧ����ƽ��״̬��ʱ����� ��
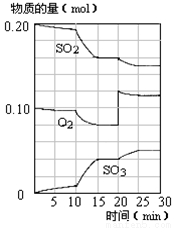
a��10-15min b��15-20min c��20-25min d��25-30min
��5����ͼ�жϣ�10min��15min�����߱仯��ԭ������� ����д��ţ���
a������SO3�����ʵ��� b������������� c�������¶� d������
��6����15����ʱ��SO2��ת������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡտ���и�����һ���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ����������
A��0��1 mol��L��1 NaOH��Һ��K����Ba2+��Cl����HCO3-
B��0��1 mol��L��1 Na2CO3��Һ��K����NH ��NO
��NO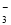 ��SO
��SO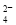
C��0��1 mol��L��1 FeCl3��Һ��K����Na����I����SCN��
D�� 0��1 mol��L��1 HCl����Һ��Ca2����Na����ClO����NO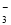
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��������������������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�����ȷ����
A.��������һ�ּ����������������ɫ�����Ϳ��
B.��ҽ����̼���ơ���������������������θ�����
C.Na2O2��ˮ��Ӧ�����ȵ�Fe��ˮ������Ӧ�������ɼ�
D.��������۵�ܸߣ����������ͻ���ϣ���Ҫ�ɷ���SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ�νο��������Ծ��������棩 ���ͣ������
��16�֣���֪ij�¶��£�
��Ӧ�٣�CO2(g)+H2(g) CO(g)+H2O(g)����H= +41.2 kJ/mol��
CO(g)+H2O(g)����H= +41.2 kJ/mol��
��Ӧ�ڣ�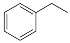 (g)
(g)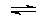
 (g)+H2(g)����H= +117.6 kJ/mol��
(g)+H2(g)����H= +117.6 kJ/mol��
�١��ڵĻ�ѧ��Ӧƽ�ⳣ���ֱ�ΪK1��K2��
��1����д��������̼�����ұ��Ʊ�����ϩ���Ȼ�ѧ��Ӧ����ʽ ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ����K1��K2��ʾ����
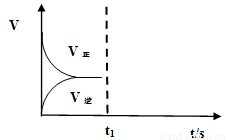
��2�����º��������£���Ӧ�ٴﵽƽ���t1ʱ��ͨ������CO2���뻭��t1֮������淴Ӧ���ߣ���������ע��
��3��һ�������£�ij�ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��c��NO2��=0.50mol/L��c��N2O4��=0.125 mol/L����2NO2��g�� N2O4��g����ƽ�ⳣ��K= (д��������) ����NO2��ʼŨ��Ϊ2 mol/L������ͬ�����·�Ӧ�ﵽƽ��ʱ��NO2��ת����Ϊ ��
N2O4��g����ƽ�ⳣ��K= (д��������) ����NO2��ʼŨ��Ϊ2 mol/L������ͬ�����·�Ӧ�ﵽƽ��ʱ��NO2��ת����Ϊ ��
��4����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g�� CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
T/�� | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
�ٸ÷�ӦΪ________��Ӧ������ȡ��������ȡ�����
����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ����� ��
A����ʱ�����CO���� B���ʵ������¶�
C������CO2��Ũ�� D��ѡ���Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и����ڶ��ε��п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ�У�����ȷ����
A����FeCl2��Һ��ͨ�� Cl2 2Fe2+ + Cl2 �� 2Fe3+ + 2Cl��
B��FeCl3��Һ��������ˮ Fe3+ + 3NH3?H2O �� Fe��OH��3�� + 3NH4+
C��̼�������Һ��ϡ���� Ca��HCO3��2 + 2H+ �� Ca2+ + 2H2O + 2CO2��
D������ˮ�ķ�Ӧ 2Na + 2H2O = 2Na+ + 2OH- + H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��ɽ�и���10���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
ijУ��ѧС��ѧ��������ͼ����װ�ý��С�����ˮ��Ӧ����ʵ�飬�����ò����һ����ȡFeCl3��6H2O���塣��ͼ�мгּ�β������װ�þ�����ȥ��
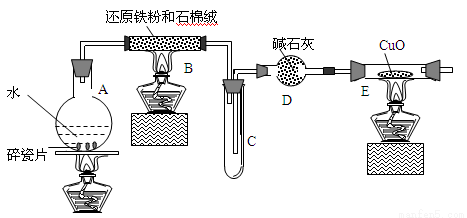
��1��װ��B�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��2��װ��E�е������� ��
��3��ֹͣ��Ӧ����B����ȴ��ȡ���еĹ��壬�������ϡ�����ַ�Ӧ�����ˡ�����������Һ��Fe3���IJ���������
��4����С������������Һ��ȡFeCl3��6H2O���壬����������£���Һ������I����FeCl3��Һ������II����FeCl3��6H2O����
�ٲ���I��ͨ��Cl2�������� ��
�ڲ���II��FeCl3ϡ��Һ�еõ�FeCl3��6H2O�������Ҫ���������� ���۸��������豣�������������Ҫԭ���ǣ�������ӷ���ʽ��Ҫ˵����________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com