

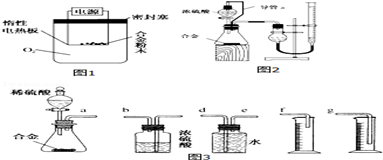
分析 根据实验装置图可知,A装置制备氯气,发生反应为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,B装置吸收氯气中混有的HCl,用饱和食盐水,C中浓硫酸吸水,干燥氯气,D中氯气与硼粉反应生成三氯化硼,三氯化硼的沸点较低,所以E装置中用冰水浴冷却收集三氯化硼,尾气中有氯气,要用氢氧化钠溶液吸收,由于三氯化硼遇水剧烈水解,为防止氢氧化钠溶液中水进入E装置与三氯化硼反应,所以在E与G之间加浓硫酸装置,
(1)根据装置图可知,仪器X为分液漏斗,分液漏斗使用前应进行检漏;
(2)根据上面的分析,B用于除去HCl气体,BCl3的沸点为12.5℃,易挥发,应冷却收集;
(3)实验时应先用氯气将装置中的空气排尽,防止三氯化硼与水反应,据此答题;
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,G装置盛装氢氧化钠溶液吸收尾气,以此判断.
解答 解:根据实验装置图可知,A装置制备氯气,发生反应为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,B装置吸收氯气中混有的HCl,用饱和食盐水,C中浓硫酸吸水,干燥氯气,D中氯气与硼粉反应生成三氯化硼,三氯化硼的沸点较低,所以E装置中用冰水浴冷却收集三氯化硼,尾气中有氯气,要用氢氧化钠溶液吸收,由于三氯化硼遇水剧烈水解,为防止氢氧化钠溶液中水进入E装置与三氯化硼反应,所以在E与G之间加浓硫酸装置,
(1)根据装置图可知,仪器X为分液漏斗,分液漏斗使用前应进行检漏,
故答案为:分液漏斗;检漏;
(2)根据上面的分析,B用于除去HCl气体,所以Y试剂为饱和食盐水,BCl3的沸点为12.5℃,易挥发,应冷却收集,所以装置E的作用是冷却和收集三氯化硼,
故答案为:饱和食盐水;冷却和收集三氯化硼;
(3)实验时应先用氯气将装置中的空气排尽,防止三氯化硼与水反应,所以应先点燃A处酒精灯,再点燃D处酒精灯,
故答案为:先点燃A处酒精灯,再点燃D处酒精灯;
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,所以若无装置F,则水会进入装置E,装置E中预期现象是有白雾产生,G装置盛装氢氧化钠溶液吸收尾气,
故答案为:有白雾产生;吸收尾气.
点评 本实验属于物质制备与检验综合设计实验,侧重于学生的分析能力和实验能力的考查,题目涉及制备气体、净化气体、干燥气体和尾气处理,明确原理是解题关键,目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2}{9}$ | B. | $\frac{1}{4}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4 | B. | NH4Cl | C. | HCl | D. | Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol.若反应中充入1mol SO2和足量的氧气反应时.放出的热量一定是Q/2kJ | |
| B. | 热化学方程式中的化学计量数表示反应物及生成物的物质的量,可以是分数 | |
| C. | 1molH2与0.5加O2反应放出的热量就是H2的燃烧热 | |
| D. | 1mol H2SO4溶液与1mol Ba(OH)2溶液反应生成BaSO4沉淀时放出的热量叫中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com