
| A. | 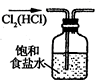 除去Cl2中HCl | B. | 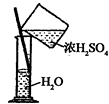 稀释浓H2SO4 | C. | 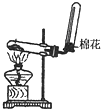 制取氧气 | D. | 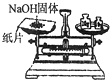 称取NaOH |
科目:高中化学 来源: 题型:解答题
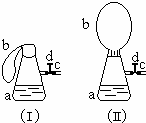 如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
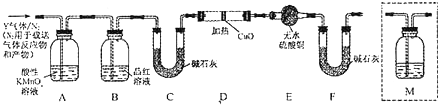
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
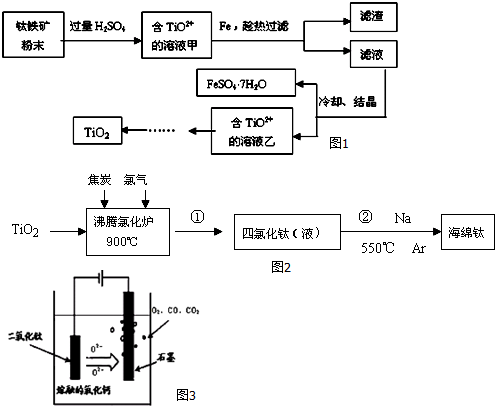
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
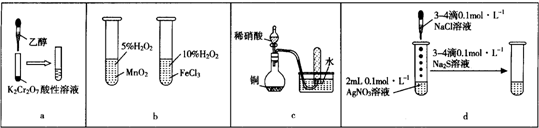
| A. | a图示装置,滴加乙醇试管中橙色溶液变为绿色,乙醇发生消去反应生成乙酸 | |
| B. | b图示装置,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. | c图示装置,根据试管中收集到无色气体,验证铜与稀硝酸的反应产物是NO | |
| D. | d图示装置,试管中先有白色沉淀、后有黑色沉淀,不能验证AgCl的溶解度大于Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,P元素属于ds区元素.
,P元素属于ds区元素.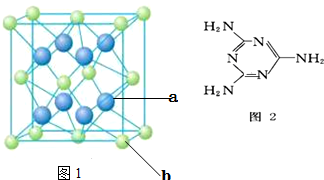
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
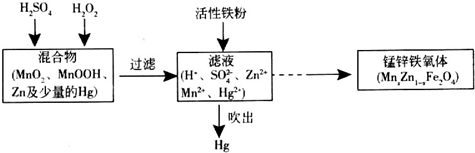
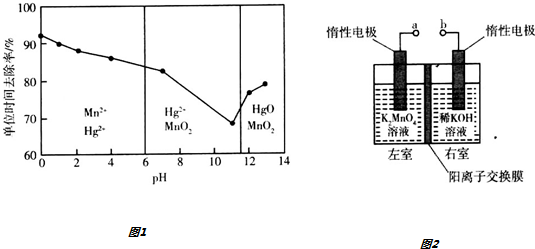
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com