
| A. | 酯、A、B三种物质的分子中都含一种相同的式量大于45的原子团 | |
| B. | A的式量比B大14 | |
| C. | B的式量比A大16 | |
| D. | 该酯中一定不含双键等不饱和键 |
分析 A氧化可得B,说明A、B的碳原子数目相等,可假设分别为RCH2OH和RCOOH,则有RCH2OH+RCOOH→RCOOCH2R+H2O,
酯的相对分子质量为212,则2M(R)+2×12+2×16+2=212,则M(R)=77,设-R为-CxHy,因酯的分子内碳原子数目等于氢、氧原子数目之和,
则有2x+2=2y+2+2,x=y+1,可能为芳香族化合物,以此解答该题.
解答 解:A氧化可得B,说明A、B的碳原子数目相等,可假设分别为RCH2OH和RCOOH,则有RCH2OH+RCOOH→RCOOCH2R+H2O,
酯的相对分子质量为212,则2M(R)+2×12+2×16+2=212,则M(R)=77,设-R为-CxHy,因酯的分子内碳原子数目等于氢、氧原子数目之和,
则有2x+2=2y+2+2,x=y+1,可能为芳香族化合物,
A.M(R)=77,所以酯、A、B 3种分子中都含有一种相对分子质量大于45的相同基团,但酯中含有两个这种基团,故A正确;
B.由以上分析可知A的式量为77+12+3+16=108,B的式量为77+12+32+1=122,则A的式量比B的式量小14,故B错误;
C.由A分析可知B的式量比A的式量大14,故C错误;
D.含有酯基,含有C=O键,故D错误.
故选A.
点评 本题考查有机物推断,侧重考查学生分析和计算能力,明确醇、羧酸生成酯时分子结构变化是解本题关键,题目难度中等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,大试管里放入一段光亮无锈的弯成螺旋状的铁丝,试管倒插入液面下,放置约一周后,观察到铁丝发生的变化是铁丝表面形成一层红棕色铁锈.
如图所示,大试管里放入一段光亮无锈的弯成螺旋状的铁丝,试管倒插入液面下,放置约一周后,观察到铁丝发生的变化是铁丝表面形成一层红棕色铁锈.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=1.5 mol•L-1•s-1 | B. | v(C)=0.5 mol•L-1•s-1 | ||
| C. | v(D)=0.6 mol•L-1•s-1 | D. | v(B)=0.4 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ/mol) | 414 | 489 | 565 | 155 |
| A. | -485kj/mol | B. | +485kj/mol | C. | +l940kj/mol | D. | -l940kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
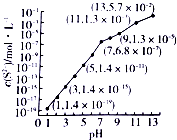 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,不可用作自来水的杀菌消毒 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| C. | 浓硫酸具有吸水性和强氧化性,可以干燥Cl2,但不能干燥SO2 | |
| D. | 铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:Cs Rb K Na Li | B. | 溶解度:NaHC03 Na2C03 CaC03 | ||
| C. | 氧化性:Li+Na+K+ Rb+Cs+ | D. | 碱性:LiOH NaOH KOH RbOH CsOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com