
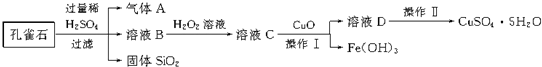
分析 孔雀石的主要成分是CuCO3•Cu(OH)2,还含有少量的SiO2和铁的化合物,加入过量稀硫酸,生成氢气A为二氧化碳气体,溶液B含有硫酸铜、硫酸亚铁等,加入过氧化氢,发生氧化还原反应,溶液C中含有硫酸铜、硫酸铁等,加入CuO可调节溶液pH,利于铁离子的水解而生成氢氧化铁沉淀,溶液D含有硫酸铜,经蒸发、结晶可得到硫酸铜晶体,
(1)检验溶液中Fe3+,可加入KSCN,亚铁离子具有还原性,能被高锰酸钾氧化为三价铁,使高锰酸钾褪色;
(2)根据H2O2+2Fe2++2H+=2Fe3++2H20的产物解答;
(3)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流.
解答 解:孔雀石的主要成分是CuCO3•Cu(OH)2,还含有少量的SiO2和铁的化合物,加入过量稀硫酸,生成氢气A为二氧化碳气体,溶液B含有硫酸铜、硫酸亚铁等,加入过氧化氢,发生氧化还原反应,溶液C中含有硫酸铜、硫酸铁等,加入CuO可调节溶液pH,利于铁离子的水解而生成氢氧化铁沉淀,溶液D含有硫酸铜,经蒸发、结晶可得到硫酸铜晶体,
(1)检验溶液中Fe3+,可加入KSCN,溶液变红色,亚铁离子具有还原性,能被高锰酸钾氧化为三价铁离子,使高锰酸钾褪色,是检验溶液A中Fe2+的最佳试剂,
故答案为:d;a;
(2)H2O2具有氧化性,在该反应中作氧化剂,亚铁离子具有还原性,发生H2O2+2Fe2++2H+=2Fe3++2H20,H2O2与Fe2+反应生成的H20为溶剂无污染,不会引入新的杂质离子,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H20;不会引入新的杂质离子;
(3)由溶液制取晶体,需经过加热浓缩,冷却结晶才可得到,在过滤操作中,除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是玻璃棒,它的作用是引流,
故答案为:冷却结晶;引流.
点评 本题考查常见金属的单质及其化合物的应用和硫酸铜结晶水含量的测定,掌握物质的制取和提纯、离子的检验等实验操作,分析图象信息是完成本题目的关键,题目较为综合,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 中和热测定 | B. | 中和滴定 | ||
| C. | 过滤 | D. | 物质的量浓度溶液配制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S与Cu反应:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | 酸雨放置过程中pH变小:2H2SO3+O2═2H2SO4 | |
| C. | 亚硫酸氢钙溶液与澄清的石灰水混合:Ca2++HSO3-+OH-═CaSO3↓+H2O | |
| D. | 向Na2S和Na2SO3的混合溶液中滴加稀H2SO4[n(Na2S):n(Na2SO3)=2:1]:2S2-+SO32-+6H+═3S↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
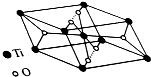 (1)下列说法正确的是AD(填序号)
(1)下列说法正确的是AD(填序号) ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
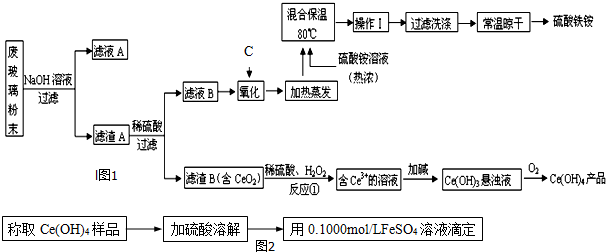
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
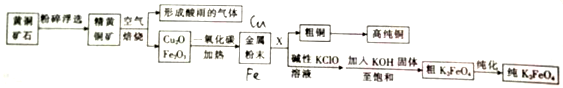
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的O2:通过灼热的CuO粉末,收集气体 | |
| B. | 某吸热反应能自发进行,则该反应一定是熵增的反应 | |
| C. |  如图是从化学试剂商店买回的硫酸试剂标签,配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL | |
| D. | 下列各种物质在一定条件下反应,所得产物与反应物的用量或与反应条件无关①Na2SiO3+CO2+H2O ②Fe+Cl2 ③Ca(HCO3)2+Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com