
【题目】下列各表述与图所示一致的是( )
A.图 用于测定NaOH溶液的浓度
用于测定NaOH溶液的浓度
B.图 表示25
表示25![]() 时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
C.图 记录滴定终点读数为12.00 mL
记录滴定终点读数为12.00 mL
D.电导率是衡量电解质溶液导电能力大小的物理量,图 表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图
表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图
科目:高中化学 来源: 题型:
【题目】(1)配平氧化还原反应方程式:
C2O42-+____MnO4-+____H+=____CO2↑+____Mn2++____H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果__________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”。
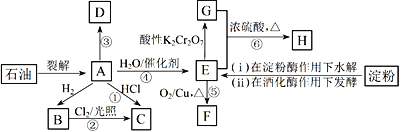
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准NaOH溶液滴定未知浓度的盐酸(盐酸放在锥形瓶中,NaOH放在滴定管中),用酚酞作指示剂,下列操作中会导致实验结果偏低的是 ( )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确.
A.①④B.②③⑤C.②⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
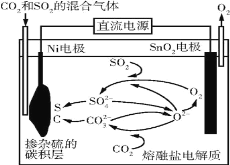
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO![]()
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y= 或
或 ],与pH的变化关系如图所示。则下列说法一定错误的是( )
],与pH的变化关系如图所示。则下列说法一定错误的是( )

A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
B.α1=α2一定等于45°
C.直线Ⅱ中M、N点一定存在c2(HSO![]() )>c(SO
)>c(SO![]() )·c(H2SO3)
)·c(H2SO3)
D.当对应溶液的pH处于1.81<pH<6.91时,溶液中的一定存在:c(HSO![]() )>c(SO
)>c(SO![]() )>c(H2SO3)
)>c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,反应![]() 的平衡常数如下:
的平衡常数如下:
温度 | 207 | 387 |
平衡常数 |
|
|
下列说法正确的是( )
A.其正反应的![]()
B.207℃时,密闭容器中进行的该反应总压不变不可以作为该反应达到平衡的标志
C.387℃时,1L密闭容器中投入![]() mol的
mol的![]() ,平衡时转化率为
,平衡时转化率为![]()
D.387℃时,1L密闭容器中充入![]()
![]() mol、
mol、![]()
![]() mol和
mol和![]()
![]() mol,则反应将向正反应方向进行
mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氢化物可作为储氢和固体电解质材料,在能源与材料领域得到了广泛而深入的研究。
(1)复合氢化物升温加热可逐步分解放出氢气,理论上单位质量的下列复合氢化物其储氢能力由高到低的顺序是_______________(填标号)。
A.Mg(NH2)2 B.NaNH2 C.H3N-BH3 D.NaAlH4 E.Li3AlH6
(2)在Mg(NH2)2和NaNH2中均存在NH![]() ,NH
,NH![]() 的空间构型为____________,中心原子的杂化方式为___________。
的空间构型为____________,中心原子的杂化方式为___________。
(3)2019年Rahm利用元素价电子的结合能重新计算各元素的电负性,短周期主族元素的Rahm电负性数值如下表所示:
元素符号 | H | ||||||
Rahm电负性 | 13.6 | ||||||
元素符号 | Li | Be | B | C | N | O | F |
Rahm电负性 | 5.4 | 9.3 | 11.4 | 13.9 | 16.9 | 18.6 | 23.3 |
元素符号 | Na | Mg | Al | Si | P | S | Cl |
Rahm电负性 | 5.1 | 7.6 | 9.1 | 10.8 | 12.8 | 13.6 | 16.3 |
①写出基态B原子的价电子轨道表达式:______________________。
②通过上表可以推测Rahm电负性小于___________________的元素为金属元素。
③结合上表数据写出H3N-BH3与水反应生成一种盐和H2的化学方程式____________________。
(4)Li3AlH6晶体的晶胞参数为a=b=801.7pm、c=945.5pm,α=β=90°、γ=120°,结构如图所示:
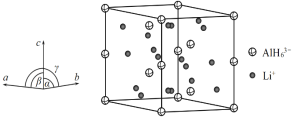
① 已知AlH![]() 的分数坐标为(0,0,0)、
的分数坐标为(0,0,0)、![]() 、
、![]() 、
、![]() 、
、![]() 和,
和,![]() ,晶胞中Li+的个数为____________。
,晶胞中Li+的个数为____________。
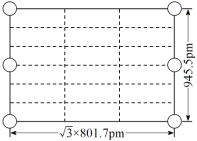
② 右图是上述Li3AlH6晶胞的某个截面,共含有10个AlH![]() ,其中6个已经画出(图中的O),请在图中用O将剩余的AlH
,其中6个已经画出(图中的O),请在图中用O将剩余的AlH![]() 画出_________________。
画出_________________。
③ 此晶体的密度为____________________________g·cm-3(列出计算式,已知阿伏加德罗常数约为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除NO是环境治理的重大课题。回答下列问题:
(1)NaClO2氧化去除NO
已知:5 NaClO2(aq)+4HCl(aq)=4ClO2(g)+2H2O(l)+5NaCl(aq) △H1
5NO(g)+3ClO2(g)+4H2O(l)=5HNO3(aq)+3HCl(aq) △H2
则反应4NO(g)+3NaClO2(aq)+2H2O(l)=4HNO3(aq)+3NaCl(aq)
△H=_____(用含△H1、△H2的代数式表示)
(2)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为NO2﹣+S2O82﹣+2OH﹣NO3﹣+2SO42﹣+H2O。
不同温度下,平衡时NO2﹣的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图所示。

①平衡时b、d两点的浓度:c(S2O82﹣)b_____c(S2O82﹣)d(填“>”、“<”或“=”)
②a、b、c三点平衡常数K由大到小的顺序为_____,原因是_____。
③常温下,反应中NO2﹣、S2O82﹣的初始浓度均为 x molL﹣1,反应达平衡时溶液pH=14,NO3﹣浓度为 y molL﹣1(忽略反应前后溶液体积的变化),该反应的化学平衡常数为_____。
(3)连二亚硫酸钠(Na2S2O4)还原去除NO。若用连二亚硫酸钠(Na2S2O4)溶液还原NO去除污染,再电解生成的NaHSO3,可再生Na2S2O4,其电解过程如图所示,质子膜允许H+和H2O通过。阴极的电极反应式为_____,将处理 n molNO后的溶液电解至恰好完全再生时,理论上生成的O2在标准状况下的体积为_____L。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com