
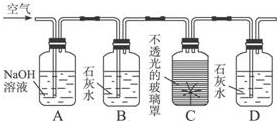
分析 可用澄清石灰水检验植物的呼吸作用生成二氧化碳,检验时可用氧气将C中二氧化碳排到D中,则需要除去空气中的二氧化碳,并用用石灰水检验是否除尽,以此解答该题.
解答 解:空气中含有的二氧化碳会对实验结果造成干扰,需要除去,氢氧化钠能与二氧化碳反应,可以使用氢氧化钠除去二氧化碳,二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀,可以石灰水检验二氧化碳是否除净,氧气进入C中将通过呼吸作用生成的二氧化碳排到D中检验,
故答案为:吸收空气中的二氧化碳; 验证空气中的二氧化碳是否完全除净;石灰水变浑浊; 呼吸作用.
点评 本题考查物质的检验实验方案的设计,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| B. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| C. | 乙烯分子与苯分子都能与H2发生加成反应,说明二者所含碳碳键相同 | |
| D. | 乙酸乙酯在碱性条件下的水解反应又叫皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
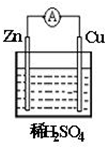 ①如图是一个原电池示意图,该原电池的负极为Zn,正极上发生还原反应.(填“氧化”或“还原”)
①如图是一个原电池示意图,该原电池的负极为Zn,正极上发生还原反应.(填“氧化”或“还原”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对废气、废水、废渣进行严格处理 | |
| B. | 在化工生产中少用或不用有害物质以及少排放或不排放有害物质 | |
| C. | 在化工生产中,不使用任何化学物质 | |
| D. | 在化工厂种草种树,使其成为花园式工厂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和W的含氧酸均为强酸 | |
| B. | YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形 | |
| C. | 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 | |
| D. | 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 反应CN-+H2O+CO2═HCN+HCO3-能够发生 | |
| B. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者 | |
| C. | 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-{c(HCOO-)}<c(K+)-c(CN-) | |
| D. | c(NH4+)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
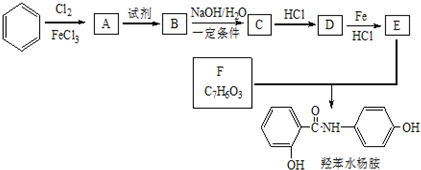
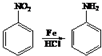
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$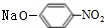 +NaCl+H2O.
+NaCl+H2O.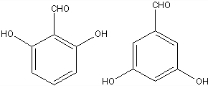 、
、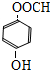 (任意一种).
(任意一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com