
【题目】实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空:
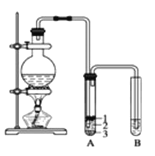
(1)盛放反应物的仪器名称是________,其中加入的反应物是溴化钠、 和 1∶1的硫酸。
(2)将生成物导入盛有冰水混合物的试管 A中,冰水混合物的作用是_____________。试管 A中的物质分为三层(如图所示),产物在第___________层。
(3)试管 A中除了产物和水之外,还可能存在_________、________(写出化学式)。
(4)用浓的硫酸进行实验,若试管 A中获得的有机物呈棕黄色,除去其中杂质的正确方法是______(选填编号)。
a.蒸馏
b.用氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
(5)若试管 B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________。
【答案】(1)圆底烧瓶 乙醇
(2)冷却、液封溴乙烷 3
(3)HBr、CH3CH2OH(4)d(5)乙烯
【解析】
试题分析:(1)根据仪器的特征,盛放反应物的仪器名称是圆底烧瓶;实验室制取少量溴乙烷所用试剂是乙醇和溴化氢在硫酸作催化剂的条件下发生反应,所以加入的反应物是溴化钠、乙醇和 1∶1的硫酸。
(2)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,所以冰水混合物的作用是冷却、液封溴乙烷;产物在第3层。
(3)在加热条件下反应,HBr和CH3CH2OH都易挥发,所以生成物中还存在HBr、CH3CH2OH。
(4)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,所以答案选d。
(5)在加热温度较高时,乙醇能发生消去反应生成乙烯,所以能使酸性高锰酸钾溶液褪色的物质是乙烯。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有一透明溶液,可能含有大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO![]() 、CO
、CO![]() 中的一种或几种,取此溶液做下列实验:
中的一种或几种,取此溶液做下列实验:
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断:

(1)溶液中一定含有的离子是______________。
(2)溶液中肯定不含有的离子是________________。
(3)可能含有的离子是____________,若要确定该离子的存在需要用到的实验方法是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室少量的金属钠保存在___________中,取用时用到的仪器和用品有小刀、玻璃片、滤纸和____________, 剩余的钠应_______________;将一小块钠投入到硫酸铜溶液中,反应的离子方程式为______________________________________,观察到的现象为_____________(填写标号)。
a.钠浮在液面上四处游动 b.钠融成了一个闪亮的小球
c.溶液中有蓝色沉淀生成 d.溶液中有红色固体析出
(2)实验室制氯气的化学反应方程式为_________________________________;氯气为有毒气体,需用氢氧化钠溶液进行尾气处理,请完成该离子方程式____________, 该原理还可用于工业制______________。
(3)下列物质既能与盐酸反应,又能与烧碱溶液反应的是________________________________
a. Al b. Mg c. CH3COONH4 d. NaHCO3 e. Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
已知①常压下反应的能量变化如图所示。

②
③CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
(4)在________(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH )3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如右图所示。

①写出甲池的A极电极反应式:______________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的_______。
A.H2SO4
B.BaSO4
C.Na2SO4
D.NaOH
E.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在酸性很弱或中性溶液中发生腐蚀时,负极上发生的电极反应是()
A.2H++2e-=H2 B.Fe2++2e-=Fe C.2H2O+O2+4e-=4OH- D.Fe-2e-=Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com