
科目:高中化学 来源:2015-2016学年福建省高一下期中理科化学试卷(解析版) 题型:选择题
一些科学家预言,存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表的第7周期,第ⅣA族,下列说法正确的是 ( )
A.第七周期有50种元素 B.该原子的质量数为184
C.该元素的相对原子质量为292 D.该原子核外有114个电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二普通版下期中化学试卷(解析版) 题型:选择题
相同质量的下列各烃,完全燃烧后消耗氧气最多的是 ( )
A.甲烷 B.乙烷 C.乙烯 D.乙炔
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安新安中学、南溪中学高一期中联考化学试卷(解析版) 题型:选择题
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
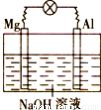
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安新安中学、南溪中学高一期中联考化学试卷(解析版) 题型:选择题
已知某可逆反应在密闭容器中进行:( )
A(g)+2B(g)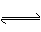 3C(g)+D(s)(正反应为放热反应),图2-28中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是( )
3C(g)+D(s)(正反应为放热反应),图2-28中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是( )

A.增大A的浓度 B.扩大容器的容积
C.加入催化剂 D.升高温度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省池州市高二5月考试化学试卷(解析版) 题型:实验题
实验室制取乙炔常因含杂质生成少量H2S,有人设计了下列实验以确证上述混合气体中含有乙炔和H2S。

(1)如图所示A、B、C、D装置中可盛放的试剂是(填序号)
A.________; B.________; C.________; D.______。
①CuSO4溶液 ②NaOH溶液 ③溴水 ④KMnO4酸性溶液
(2)能说明H2S气体存在的现象是___ _____,
(3)使用装置B的目的是______ _,
(4)使用装置C的目的是___ ,
(5)确证含有乙炔的现象是___ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省池州市高二5月考试化学试卷(解析版) 题型:选择题
1-丙醇的蒸气和空气混合,通过灼热的铜网生成一种新的化合物。下列物质中,和该化合物互为同分异构体的是
A.CH3CH2CHO B.CH3CH2COOH C.CH3COCH3 D.CH3CH2OCH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高一5月月考化学试卷(解析版) 题型:简答题
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍。
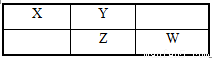
请回答下列问题:
(1)元素W的最高价氧化物对应的水化物的化学式为 ;
(2)这些元素的氢化物中,水溶液碱性最强的化合物是 (写化学式);
(3)X、Y、Z、W形成的简单阴离子半径大小顺序为 (用离子符号填空);证明W的非金属性比强Z的最简单方法是 (用化学方程式填空);
(4)Z的低价氧化物通入W的单质形成的水溶液中反应的化学方程式: ;
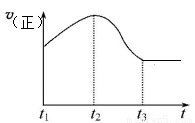
(5)Z的低价氧化物能与Y的单质在一定体积的密闭容器反应,该反应属于 (填“可逆反应”或“非可逆反应”),反应速率与时间关系如图所示,t1到t2反应速率逐渐加快的原因是 ,在 (填“t1”“t2”或“t3”)时达到平衡;对该反应,下列说法正确的是 。
A.Y的单质是氧化剂
B.混合气体的密度不再改变,可以判断反应达到平衡状态
C.Z的低价氧化物能使品红褪色
D.反应达到平衡状态时,反应停止
(6)将一定量的W单质通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaW、NaWO、NaWO3共存体系,则消耗的W单质的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷参考版) 题型:填空题
CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O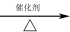 CO+3H2
CO+3H2
已知:CO+2H2 CH3OH CO2+3H2
CH3OH CO2+3H2 CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com