
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
 由此不能判断
由此不能判断
A.1,3-丁二烯和2-丁炔稳定性的相对大小
B.1,3-丁二烯和2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
下列各组物质加入足量水,形成悬浊液,一段时间后,加入过量盐酸,浑浊部分消失且有无色无味气体生成的是( )
A.Ba(NO3)2和Na2SO3 B.BaCO3和Na2SO4
C.BaCl2和Na2SO4 D.Ca(HCO3)2和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系: 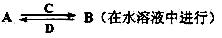
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B 为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为
为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为  。
。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为________(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>________。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态 化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式__________________________________________。
化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式__________________________________________。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
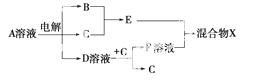
①写出D溶液与G反应的化学方程式_________________________________________
________________________________________________________________________。
②写出检验A溶液中溶质的阴离子的方法:_____________________________________
________________________________________________________________________。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为________mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢 H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+ 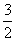 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=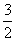 S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+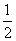 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A.△H4=2/3(△H1+△H2-3△H3)
B.△H4=2/3(3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)
D.△H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则H CN在水溶液中电离的ΔH等于 ( )。
CN在水溶液中电离的ΔH等于 ( )。
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 锥形瓶可用作加热的反应器 |
|
| B. | 室温下,不能将浓硫酸盛放在铁桶中 |
|
| C. | 配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高 |
|
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾:
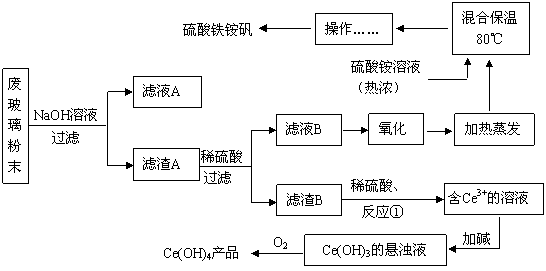
已知:
Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸;
Ⅲ.硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理。
(1)滤液A的主要成分 (填写化学式)。
(2)写出反应①的离子方程式 。
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是
。
(4)稀土元素的提纯,还可采用萃取法。已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
 |
所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质
量分数 。(填“偏大”、“偏小”或“无影响”)
(6)已知Fe3+沉淀的pH范围:2.2~3.2,Fe2+沉淀的pH范围:5.8~7.9,Zn2+沉淀的pH范围:5.8~11.0,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。现用FeSO4溶液(含有ZnSO4杂质)来制备硫酸铁铵矾。实验中可选用的试剂: KMnO4溶液、30%H2O2、 NaOH溶液、饱和石灰水、稀H2SO4溶液、稀盐酸。
实验步骤依次为:
①向含有ZnSO4杂质的FeSO4溶液中,加入足量的NaOH溶液至pH>11, ;
② ;
③向②中得到的溶液中加入硫酸铵溶液, ,过滤、洗涤、常温晾干,得硫酸铁铵晶体(NH4) Fe(SO4)2·12H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com