
| A. | 碳酸钙受热分解 | B. | 盐酸与氢氧化钠反应 | ||
| C. | 甲烷燃烧 | D. | 铝粉与盐酸反应 |
分析 反应中反应物的总能量小于生成物的总能量,说明该反应为吸热反应,常见的吸热反应有:①氢氧化钡晶体与氯化铵晶体的反应,②大多数分解反应,③C、氢气或CO为还原剂的氧化还原反应等,据此进行解答.
解答 解:反应中反应物的总能量小于生成物的总能量,说明该反应为吸热反应,
A.碳酸钙的分解反应为吸热反应,故A选;
B.盐酸与氢氧化钠的反应为中和反应,中和反应为放热反应,故B不选;
C.甲烷的燃烧反应为放热反应,故C不选;
D.铝粉与盐酸的反应为放热反应,故D不选;
故选A.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确反应物、生成物总能量与吸热反应、放热反应之间的关系为解答关键,注意掌握常见的吸热反应、放热反应,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{H_{2}O}{→}$Cu(OH)2 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3溶液$\stackrel{NaOH、过滤、加热}{→}$Fe2O3 | |
| C. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| D. | Na$→_{△}^{O_{2}}$Na2O$\stackrel{CO_{2}}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
 C6H5COOCH3+H218O.
C6H5COOCH3+H218O.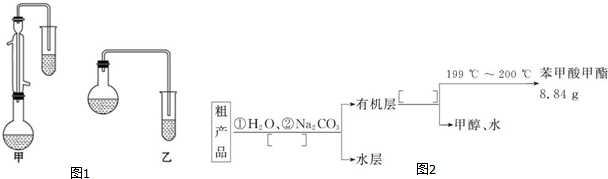
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
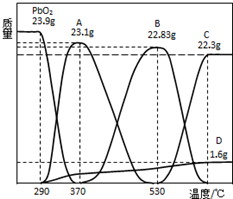 某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)
某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)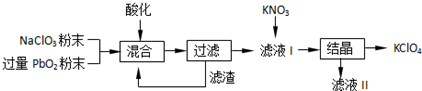
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
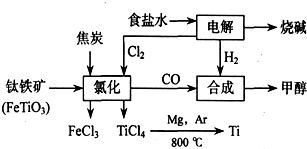
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
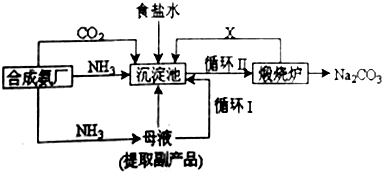
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com