
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑪ | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑪为F.
(1)稀有气体的化学性质最不活泼;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)元素⑦的氢化物H2O,常温下K与水反应生成KOH与氢气,氯气与水反应生成HCl与HClO;
(5)①和⑨的最高价氧化物对应的水化物的NaOH、HBrO4,①和⑨两元素形成化合物为NaBr,含有钠元素,该化合物灼烧时焰色为黄色,氯气与溴化钠反应生成氯化钠与溴单质;
(6)①和⑤最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(7)⑥和⑧形成的化合物为CCl4,该化合物溶解⑨的单质所得溶液为溴的CCl4溶液;
(8)非金属性越强,氢化物越稳定.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑪为F.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,故答案为:Ar;
(2)金属性K>Ca>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故KOH的碱性最强,故答案为:KOH;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:K+>Ca2+>Mg2+,故答案为:K+>Ca2+>Mg2+;
(4)元素⑦的氢化物H2O,常温下K与水反应生成KOH与氢气,反应离子方程式为2K+2H2O═2K++2OH-+H2↑,氯气与水反应生成HCl与HClO,反应离子方程式为Cl2+H2O═H++Cl-+HClO,
故答案为:H2O;2K+2H2O═2K++2OH-+H2↑;Cl2+H2O═H++Cl-+HClO;
(5)①和⑨的最高价氧化物对应的水化物的NaOH、HBrO4,①和⑨两元素形成化合物为NaBr,含有钠元素,该化合物灼烧时焰色为黄色,氯气与溴化钠反应生成氯化钠与溴单质,反应离子方程式为:Cl2+2Br-═2Cl-+Br2,
故答案为:NaOH;HBrO4;NaBr;黄色;Cl2+2Br-═2Cl-+Br2;
(6)①和⑤最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3═NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3═NaAlO2+2H2O;
(7)⑥和⑧形成的化合物为CCl4,⑨的单质为溴,溶于四氯化碳所得溶液为溴的CCl4溶液,故答案为:CCl4;溴的CCl4溶液;
(8)同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,故HF最稳定,故答案为:HF.
点评 本题考查元素周期表与元素周期律,需要学生熟练掌握元素周期表,侧重对基础知识的巩固,难度不大.


科目:高中化学 来源: 题型:选择题
| X | Y | ||
| T | Z | W |
| A. | X、Y两种元素最低价氢化物的稳定性后者大 | |
| B. | Z、W 元素最高价氧化物对应的水化物酸性后者强 | |
| C. | X与Z形成的晶体类型为分子晶体 | |
| D. | T分别与X、Y、W 形成的化合物均具有熔点高,硬度大的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
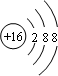 ,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为:
,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为: .AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.
.AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.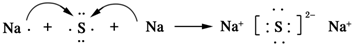 .该化合物属于离子(填“共价”或“离子”)化合物.
.该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学计量数:a+b>c | B. | 平衡向逆反应方向移动了 | ||
| C. | 物质B的转化率增加了 | D. | 物质B的物质的量增加了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )| A. | A分子属于酯类化合物,在一定条件下不能发生水解反应 | |
| B. | A在一定条件下可与4 mol H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物只有1种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 63.47 | B. | 64.47 | C. | 63.57 | D. | 64.57 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油和花生油都可发生皂化反应 | |
| B. | 蚕丝、棉、麻、的主要成分都是纤维素 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 加热马铃薯可使其中的淀粉变成葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com