
| A、H+、K+、Fe2+、NO3- |
| B、OH-、Cl-、Na+、Mg2+ |
| C、Al3+、K+、Cl-、NO3- |
| D、Cu2+、NO3-、OH-、Cl- |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、①④ | B、②③ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加压 | B、加大水量 |
| C、升温 | D、减压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、由乙二醇制取高分子 是通过加聚反应完成的 是通过加聚反应完成的 |
| B、乙醇在浓硫酸作催化剂,并且加热的条件下一定发生消去反应 |
| C、卤代烃一般来说在NaOH的水溶液中能发生取代反应,而在NaOH的醇溶液中不一定能发生消去反应 |
| D、酯类物质在一定条件下水解一定得到相应的羧酸和醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
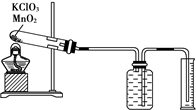 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下:
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com