
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
分析 三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体,可以确定固体物质中含有铁元素、铜元素,从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀,红色沉淀是金属铜,根据元素守恒可以确定含铜物质的量的多少,上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,气体可以是物质和碳酸氢钠反应生成的二氧化碳气体和另一种气体,也可以是原来产生的两种气体的保留,根据选项中的物质来确定物质的组成情况.
解答 解:加入0.15 mol Fe,置换出Cu为6.4 g,说明原黑色粉末含CuO为0.1 mol,同时,只需0.1 mol Fe即可,实际上多消耗0.05molFe是和Fe3+反应了.则黑色粉末中含Fe或FeS 0.1 mol,而加入的某酸必为强氧化性酸,浓HNO3或浓H2SO4. 若为浓H2SO4,则产生两种气体只可能是SO2和CO2,但其通过NaHCO3溶液时,则只能得到一种气体CO2,所以某酸只能是浓HNO3.加入浓HNO3产生CO2和NO2,而经过计算知n(CuO)=0.1 mol,n(Fe)=0.1 mol,两者共消耗HNO3为2n(CuO)+6n(Fe)=0.8 mol,则用于和碳反应:HNO3为0.1×14-0.8=0.6 mol,根据HNO3和碳的反应可推知碳应为0.15 mol,所以B正确.
故选B.
点评 本题考查学生物质的性质以及成分的判断,注意元素守恒思想的灵活应用是关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
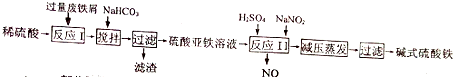
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al浓硝酸不反应 |
| C | 将盐酸滴入NaOH溶液 | 无现象 | 盐酸与氢氧化钠不反应 |
| D | 将水蒸气通过灼热铁粉 | 粉末变红 | 铁水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
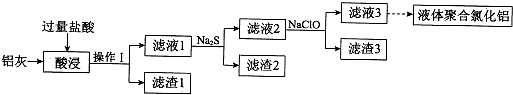
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
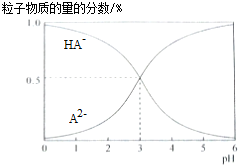
| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| C. | 容器①中CO反应速率等于H2O的反应速率 | |
| D. | 平衡时,两容器中CO2的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com