
| A. | 高温、高压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 高温、高压、催化剂 |
分析 增加甲醇的产量,应改变条件使平衡向正反应方向移动,反应速率不能太低,且要加快反应速率,结合反应特征及外界条件对平衡移动、反应速率影响分析解答.
解答 解:A.该反应正反应是体积减小的放热反应,增大压强平衡向正反应方向移动,有利于甲醇的生成,但升高温度平衡向逆反应方向移动,不利于甲醇的生成,不利于增加甲醇的产量,故A错误;
B.该反应正反应是体积减小的反应,增大压强平衡向正反应方向移动,有利于甲醇的生成,使用催化剂加快反应速率,适宜的温度使催化剂的活性高,且反应速率较快,有利于增加甲醇的产量,故B正确;
C.该反应正反应是体积减小的放热反应,减小压强平衡向逆反应方向移动,不利于甲醇的生成,降低温度平衡向正反应方向移动,有利于甲醇的生成,但温度过低,反应速率较慢,不利于增加甲醇的产量,故C错误;
D.该反应正反应是体积减小的放热反应,增大压强平衡向正反应方向移动,有利于甲醇的生成,但升高温度平衡向逆反应方向移动,不利于甲醇的生成,高温下催化剂活性较差,不利于增加甲醇的产量,故D错误;
故选B.
点评 本题考查反应条件的控制、外界条件对反应速率与平衡移动的影响,难度不大,注意是题目要求是增大产量不增大产率,容易按产率解答.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
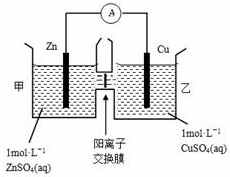
| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| C. | 电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) | |
| D. | 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32g | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m1>m2时,溶液a中的阴离子只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| C. | CO2的水溶液:c(HCO3-)>c(H+)>c(CO32-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
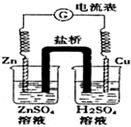
| A. | 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降 | |
| B. | 盐桥的作用是让电子通过,以构成闭合回路 | |
| C. | 随着反应进行,右烧杯中溶液pH变小 | |
| D. | 总反应为:2H++Zn═H2↑+Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述两个反应中,当有1molP参加反应时,反应转移电子数均为5NA | |
| B. | 在反应(2)中,当生成3mol硫酸时,被还原的P为1mol | |
| C. | 在上述两个反应中,P均作还原剂 | |
| D. | 在上述两个反应中,还原产物都是H3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com