
| A. | 磁性氧化铁溶于足量稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3(胶体)+CO32- | |
| D. | 氯气与水反应:Cl2+H2O=2H++ClO-+Cl- |
分析 A.二者反应生成硝酸铁、一氧化氮和水;
B.氢氧化钠少量,反应生成碳酸钙和碳酸氢钠;
C.二氧化碳过量反应生成硅酸和碳酸氢钠;
D.次氯酸为弱酸,应保留化学式;
解答 解:A.磁性氧化铁溶于足量稀硝酸,离子方程式:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故A正确;
B.Ca(HCO3)2溶液中加入少量NaOH溶液,离子方程式:Ca2++HCO3-+OH-═CaCO3↓+H2O,故B错误;
C.向Na2SiO3溶液中通入过量CO2,离子方程式:SiO32-+2CO2+2H2O=H2SiO3(胶体)+2HCO3-,故C错误;
D.氯气与水反应,离子方程式:Cl2+H2O=H++HClO+Cl-,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
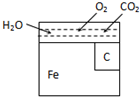 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H3PO4>HNO3 | B. | 氢化物稳定性:HF>H2O>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 氧化性:F2>O2>N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化 学 键 | C-H | O-O | O=O | C-O | C=O | H-O |
| 能量 (kJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800 kJ | B. | 放出热量1520 kJ | C. | 吸收热量110 kJ | D. | 放出热量610 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(苯):蒸馏 | B. | 苯(苯酚):加溴水振荡后,过滤 | ||
| C. | 乙烷(乙烯):溴水,洗气 | D. | 苯(溴):稀NaOH溶液,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| B. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | X、Y、Z三种元素氢化物的沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
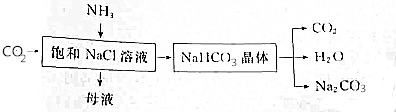
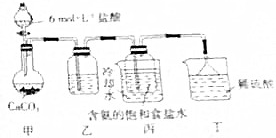
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com