
| A. | 目前元素周期表有7个周期 | B. | 元素周期表有8个主族 | ||
| C. | ⅢA族元素全部是金属元素 | D. | 非金属元素都在ⅣA~ⅤⅡA和0族 |
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的氨水溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单晶硅太阳能电池的光电转换效率为100% | |
| B. | 高溫下碳能将二氧化硅还原为硅,则C的非金属性比Si强 | |
| C. | Mg2Si与盐酸作用制得硅烷的方程式为:Mg2Si+4HCl═2MgCl2+SiH4↑ | |
| D. | 一种硅酸盐云母[KAl2(AlSi3O10)(OH)2用氧化物形式可表示为:K2O•3Al2O3•6SiO2•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 甲 | 乙 | 丙 |
| A | NaHCO3 | HCl | Ca(OH)2 |
| B | O2 | SO2 | NaOH |
| C | NH3 | NO2 | H2O |
| D | H2SO4(浓) | Fe | S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
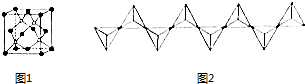
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
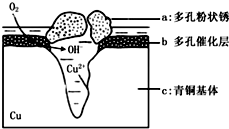 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )
如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )| A. | 腐蚀过程中,负极是 b 和 c | |
| B. | 生 成 Cu 2( OH )3 Cl 的 离子方程式为:2Cu2++3OH -═Cu 2( OH ) 3+ | |
| C. | 若生成 4.29gCu 2( OH )3 Cl,则理论上消耗标准状况氧气体积为0.448L | |
| D. | 正极的电极反应式为:O 2-4e-+2H+═2OH - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
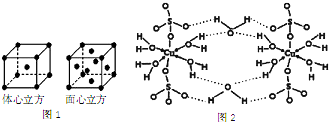
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com