
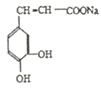
【题目】I.咖啡酸(如图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。
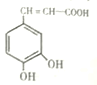
(1)咖啡酸与![]() 溶液反应的方程式为_______。
溶液反应的方程式为_______。
(2)蜂胶的主要活性成分为CPAE,分子式为![]() ,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为_____。
,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为_____。
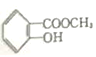
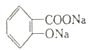
II.已知A的结构简式为:![]()
(1)写出A与NaOH溶液共热的化学方程式:______。
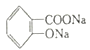
(2)A的同分异构体Ⅰ和J是重要的医药中间体,在浓硫酸的作用下,Ⅰ和J分别生成![]() 和
和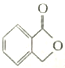 ,鉴别Ⅰ和J的试剂为_______________。
,鉴别Ⅰ和J的试剂为_______________。
(3)A的另一种同分异构体K用于合成高分子材料,K可由![]() 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:_______________
制得,写出K在浓硫酸作用下生成的聚合物的结构简式:_______________
【答案】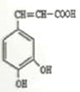 +NaHCO3
+NaHCO3![]()
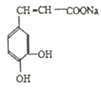 +CO2
+CO2![]() +H2O
+H2O ![]()
 +2 NaOH
+2 NaOH![]()
 +CH3OH+ H2O 浓溴水或
+CH3OH+ H2O 浓溴水或![]() 溶液
溶液 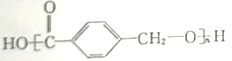
【解析】
根据羧基和酚羟基的性质分析解答;根据缩聚反应原理分析解答;根据有机物的官能团的结构及性质分析解答。
(1)根据咖啡酸结构简式可知,咖啡酸含有羧基,与![]() 溶液反应生成CO2,方程式为:
溶液反应生成CO2,方程式为: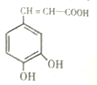 ++NaHCO3
++NaHCO3![]()
 +CO2
+CO2![]() +H2O;
+H2O;
(2)分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,说明CPAE含有酯基,该醇为芳香醇且分子结构中无甲基,由分子式可知该醇为![]() ;
;
II.已知A的结构简式为:![]()
(1)有结构简式可知,A中含有酚羟基和酯基,则A与NaOH溶液共热,反应生成酚钠和羧酸钠,化学方程式: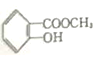 +2 NaOH
+2 NaOH![]()
 +CH3OH+ H2O;(2)A的同分异构体Ⅰ和J是重要的医药中间体,在浓硫酸的作用下,Ⅰ和J分别生成
+CH3OH+ H2O;(2)A的同分异构体Ⅰ和J是重要的医药中间体,在浓硫酸的作用下,Ⅰ和J分别生成![]() 和
和 ,则I为邻羟基苯乙酸,J为邻羧基苯甲醇,其中I中含有酚羟基,J中不含有酚羟基,即I遇FeCl3溶液显紫色,遇溴水生成沉淀,故鉴别
,则I为邻羟基苯乙酸,J为邻羧基苯甲醇,其中I中含有酚羟基,J中不含有酚羟基,即I遇FeCl3溶液显紫色,遇溴水生成沉淀,故鉴别![]() 溶液;
溶液;
(3)根据K可由![]() 制得,可知K是对羧基苯甲醇,则K中的羧基与羟基发生缩聚反应得到聚合物的结构简式:
制得,可知K是对羧基苯甲醇,则K中的羧基与羟基发生缩聚反应得到聚合物的结构简式: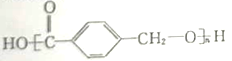 。
。


科目:高中化学 来源: 题型:
【题目】近期《美国化学会杂志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在479℃、80Mpa下合成金刚石,这具有深远的意义。
⑴二氧化碳合成金刚石是______变化。
⑵金刚石和______互称 “同素异形体”,只含有______键。
⑶钠与二氧化碳反应生成金刚石与碳酸钠的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂白精与盐酸),然后分别滴加所要进行实验的试剂,如图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是
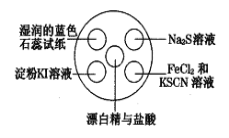
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉KI溶液变蓝 | 氯气置换出KI中的碘使淀粉变蓝 | 单质氧化性:Cl2>I2 |
B | Na2S溶液中出现淡黄色沉淀 | 氯气置换出Na2S中的硫 | 单质氧化性:Cl2>S |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D | FeCl2和KSCN溶液的小液滴变红 | FeCl2被Cl2氧化成FeCl3后,再与KSCN溶液反应变红 | 氯气具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,下列关于萜类化合物的说法错误的是
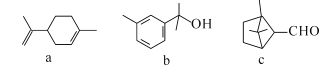
A.c和b互为同分异构体
B.c的分子式是C10H16O
C.a、b、c均能发生加成反应
D.a、b、c中共有三种官能团,且都可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物烃A、B和C的结构如下图,下列有关说法正确的是
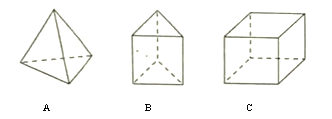
A. A的二氯代物结构有两种
B. B的分子式为![]()
C. 与C互为同分异构体且属于芳香烃的有机物可能使酸性高锰酸钾溶液褪色
D. A、B、C中只有C的最简式为CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有以下四种气体:①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3。下列关系不正确的是( )
A.体积:④<①<③<② B.质量:④<①<③<②
C.物质的量:①<②<③<④ D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组的同学,为测定某含铜3%~5%的铝铜合金(不含其它元素)中铜的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]将铝铜合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___。
(2)称取5.4g铝铜合金粉末样品,溶于VmL2.0mol/LNaOH溶液中。为使其反应完全,则NaOH溶液的体积V≥___mL。过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铜的质量分数将__(填“偏高”、“偏低”或“无影响”)。
[方案二]将铝铜合金与足量稀硫酸溶液反应,用量筒或者量气管测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
(3)同学们拟选用图1实验装置完成实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因___。
(4)实验结束时 ,生成氢气的体积近似等于___。
(5)锥形瓶中残存的氢气对实验结果是否有影响___(填“有”“没有”或“不能判断”)
(6)同学们仔细分析图1实验装置后,经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图2的实验装置。
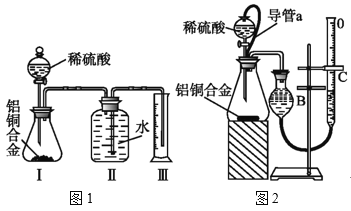
①装置中导管a的作用是___。
②实验中准确测定出实验前铝铜合金质量m1g,实验后铝铜合金质量m2g,产生的气体体积为(V2-V1)ml。利用上述数据计算通常状况下的气体摩尔体积:Vm=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:

请回答下列问题。
(1)滤渣Ⅰ的主要成分是___(填化学式)。
(2)从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是___、___、过滤、洗涤、干燥。
(3)还原时,试剂X若选用SO2,则该反应的离子方程式为___。
(4)绿矾(FeSO4·7H2O)若保存不当或长期放置,易与空气中的氧气反应,检验绿矾是否被氧化的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com