
��֪ij��ӦaA(g) +bB(g)  cC(g) ��H ="Q" ���ܱ������н��У��ڲ�ͬ�¶ȣ�T1 ��T2 ����ѹǿ��P1 ��P2 ���£����������B����������w(B)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����
cC(g) ��H ="Q" ���ܱ������н��У��ڲ�ͬ�¶ȣ�T1 ��T2 ����ѹǿ��P1 ��P2 ���£����������B����������w(B)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����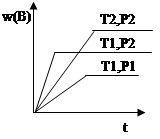
A��T1��T2�� P1��P2 ��a+b��c ��Q��0
B��T1��T2 ��P1��P2 ��a+b��c ��Q��0
C��T1��T2 ��P1��P2 ��a+b��c�� Q��0
D. T1��T2 ��P1��P2 ��a+b��c ��Q��0
B
���������������ͼ���֪���¶�ΪT1ʱ�����ݵ���ƽ���ʱ���֪P2��P1����ѹǿԽ��B�ĺ���Խ�ߣ�˵��ѹǿ����ƽ�����淴Ӧ�����ƶ���������ӦΪ�����������ķ�Ӧ����a+b��c��ѹǿΪP2ʱ�����ݵ���ƽ���ʱ���֪T1��T2�����¶�Խ�ߣ�B�ĺ���Խ�ߣ�˵���¶�����ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ����Q��0����B����ȷ��
���㣺���⿼�黯ѧƽ��ͼ��ķ����������Է�Ӧ���ʺͻ�ѧƽ���Ӱ�졣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ��������,ͨ�����з�Ӧ��ʵ��ȼú��������Ļ���:
SO2(g)+2CO(g) 2CO2(g)+S(l) ��H<0����Ӧ�ں��ݵ��ܱ������н���,�����й�˵����ȷ���� �� ��
2CO2(g)+S(l) ��H<0����Ӧ�ں��ݵ��ܱ������н���,�����й�˵����ȷ���� �� ��
| A��ƽ��ǰ,���ŷ�Ӧ�Ľ���,������ѹǿʼ�ղ��� |
| B��ƽ��ʱ,������������,�������,����Ӧ���ʼӿ� |
| C��ƽ��ʱ,������������,�����¶ȿ����SO2��ת���� |
| D��������������,ʹ�ò�ͬ����,�÷�Ӧ��ƽ�ⳣ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���¶��£�������X������Y ��0.16 mol����10 L �����ܱ������У�������ӦX��g��+ Y��g�� 2Z��g�� ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���������
2Z��g�� ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���������
| t / min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������298K��101kPaʱ����1Lˮ�п��ܽ�0.09mol��ʵ��������ˮ��Cl2Լ������֮һ��ˮ��Ӧ������÷�Ӧ��ƽ�ⳣ���� ��
| A��5.4��10��5 | B��4.5��10��4 | C��0.015 | D�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ܱ������н������з�ӦM(g)��N(g)  R(g)��2 L����ͼ��ʾR%��R�����������t��ʱ�䣬���й��ڸ÷�Ӧ�ķ�����ȷ����( )
R(g)��2 L����ͼ��ʾR%��R�����������t��ʱ�䣬���й��ڸ÷�Ӧ�ķ�����ȷ����( )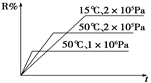
| A������Ӧ���ȣ�LΪ���� |
| B������Ӧ���ȣ�LΪ�����Һ�� |
| C������Ӧ���ȣ�LΪ���� |
| D������Ӧ���ȣ�LΪ�����Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ڿ��淴ӦN2(g)��3H2(g)  2NH3(g)����H��0�������о�Ŀ�ĺ�ʾ��ͼ�������
2NH3(g)����H��0�������о�Ŀ�ĺ�ʾ��ͼ�������
| | A | B | C | D |
| �о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ��(p2��p1) | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ������N2��Ũ�ȶԷ�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
| ʾ��ͼ |  | 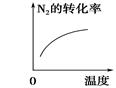 | 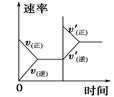 |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ʵ����������������һ������ijŨ�ȵ����ᷴӦ���Ƶ����������ڷ�Ӧ����̫�죬���ײ�����Ϊ������Ӧ���ʣ�ͬʱ�ֲ�Ӱ������H2�����������������м���������ǣ� ��
| A��CH3COONa���� | B��NaOH��Һ | C��(NH4)2 SO4��ĩ | D��K2 SO4���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й���������[��֪N2(g)��3H2(g)  2NH3(g)����H����92.4 kJ/mol]������˵����ȷ����
2NH3(g)����H����92.4 kJ/mol]������˵����ȷ����
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1 mol N2��3 mol H2 | 2 mol NH3 | 4 mol NH3 |
| NH3��Ũ��(mol/L) | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�a kJ | ����b kJ | ����c kJ |
| ��ϵѹǿ(Pa) | p1 | p2 | p3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���¶��¿��淴ӦN2+3H2 2NH3�Ѵﵽƽ�⣬�����й�˵����ȷ�� �� ��
2NH3�Ѵﵽƽ�⣬�����й�˵����ȷ�� �� ��
��1��N��N�����ѵ�ͬʱ����3��H��H���γ�
�ڷ�Ӧ������и���ֵ�����������ֲ���
�ۺ��º���ʱ�������ڵ�ѹǿ���ٸı�
��1��N��N�����ѵ�ͬʱ����3��N��H ���γ�
��NH3���ɵ�������NH3�ֽ���������
��λʱ������n molN2��ͬʱ����2n molNH3
�������ƽ����Է����������ٸı�
��N2 H2 NH3�ķ�����һ��Ϊ1��3��2
����º���ʱ������������ʵ������ٸı�
����º�ѹʱ�������ڵ��ܶȲ��ٸı�
| A���٢ڢۢܢݢޢߢ� | B���٢ڢۢݢޢ� |
| C���ۢܢݢޢߢ� | D���٢ڢۢݢޢߢ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com