
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将Na2CO3溶液由0.1mol/L 稀释到0.01mol/L,测溶渡pH | 溶液pH变小 | 稀释后CO32-的水解程度减小 |
B | 向一定浓度的CuSO4溶液中 通入适量的H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
C | 将盛有棕红色NO2气体的注射 器由10 mL 压缩至5 mL | 气体颜色比压 缩前变浅 | 反应2NO2 |
D | 在新生成的AgCl 沉淀中滴入 稀KI溶液,振荡 | 白色沉淀转化为 黄色沉淀 | Ksp (AgCl )>Ksp (AgI) |
A. A B. B C. C D. D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】芳香族化合物A和E可以合成芳香酯I,合成路线如图所示:
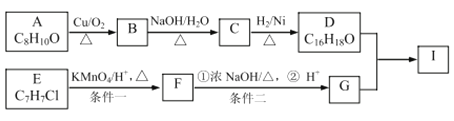
已知:
①![]()
②2RCH2CHO![]()
③B的苯环上只有一个取代基,且能发生银镜反应;
④E的核磁共振氢谱有3组峰
请回答下列问题:
(1)A的结构简式为________,B的化学名称是________ 。
(2)C→D的反应类型为________,F中所含官能团的名称是________ 。
(3)条件一与条件二能否互换____(填“能”或“否”),原因是_________ 。
(4)写出D与G反应的化学方程式_______________ 。
(5)A的同分异构体很多,其中能使FeCl3溶液显紫色有___种,写出其中一种核磁共振氢谱有4组峰的分子的结构简式________ 。
(6)结合题中信息,写出以溴乙烷为原料制备1-丁醇的合成路线图______ (无机试剂任选),合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A. ![]() 、
、 ![]() 是质量数和电子数相等的两种微粒,中子数也相等
是质量数和电子数相等的两种微粒,中子数也相等
B. ![]() 原子的质子数与中子数差50
原子的质子数与中子数差50
C. 35Cl和37Cl两者互为同位素
D. 当氘原子转变为氕原子发生了分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:

已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)![]() 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/ L NaOH 溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/LCH3COOH溶液,得到2 条滴定曲线,如下图所示:
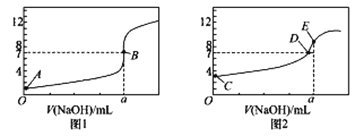
(1)由A、C点判断,滴定HCl溶液的曲线是_____(填“图1”或“图2”);
(2)a=____ mL;
(3)c(Na+ )=c(CH3COO-)的点是_________;
(4)E点对应离子浓度由大到小的顺序为___________________________。
(5)当NaOH 溶液滴定CH3COOH 溶液过程中,NaOH溶液消耗了10.00 mL时,则此时混合液中c(CH3COOH)____c (CH3COO-)(“>”或“<”或“=” )。
(6)在25℃ 时,将c mol/L的醋酸溶液与0.2mol/LNaOH溶液等体积混合后溶液恰好星中性,用含c 的代数式表示CH3COOH 的电离常数Ka=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,2.24LCO和 CO2混合气体中含有的碳原子数目为0.1NA
B. 在非标准状况下,1mol任何气体的体积不可能是22.4L
C. 标准状况下,22.4L酒精(CH3CH2OH)的分子数为NA
D. 同温同压下,相同质量的二氧化碳和二氧化硫的体积比是16:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)十O2(g)![]() 2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. 在恒温、恒容条件下,达到平衡后继续加入少量SO3平衡将向正反应方向移动,所以SO3的体积百分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com