
(1)在一定的温度下,向甲中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3的物质的量为a mol。?
①相同的温度下,向乙中通入2 mol NH3,且保持容积与甲相同,当反应达到平衡时,各物质的浓度与甲中平衡时相同。起始时乙中通入 mol N2和 mol H2。?
②相同温度下,若乙中通入6 mol N2和8 mol H2,且保持压强与甲相同,当反应达到平衡时,生成NH3的物质的量为b mol,则![]()
![]() ;若乙与甲的容积始终相等,达到平衡时,生成的NH3的物质的量为c mol,则
;若乙与甲的容积始终相等,达到平衡时,生成的NH3的物质的量为c mol,则![]()
![]() (选填“>”“<”“=”)。?
(选填“>”“<”“=”)。?
(2)相同的温度下,向甲和乙两容器中分别通入2 mol NH3,甲保持体积不变,乙保持压强不变。?
①达到平衡时,甲容器速率比乙容器速率 ,甲容器中NH3的转化率比乙容器 。?
②达到①所述平衡后,若向两容器中通入数量不多的等量氩气,甲容器内的化学平衡________移动,乙容器内的化学平衡 移动(选填“向正反应方向”“向逆反应方向”或“不”)。③达到①所述平衡后,测得甲容器平衡体系的平均相对分子质量为M,则此条件下NH3的分解率为 (用M的代数式表示)。?
(1)①2 1 ②= <?
(2)①快 小
②不 向正反应方向
③(![]() -1)×100%
-1)×100%
解析:(1)①根据氮原子和氢原子守恒,得n(N2)=2 mol,n(H2) =1 mol。②在恒温恒压下,由于起始时,n(N2)∶n(H2)=3∶4=6∶8,则两平衡等效,平衡时反应混合物对应各组分的物质的量分数相等,且n(乙)=2n(甲),得b=2a;由于上述平衡时,v(乙)=2v(甲),将乙的容器体积缩小一半,平衡向正反应方向移动,则平衡时c>b=2a。(2)①由于反应2NH3(g)![]() N2(g)+3H2(g)是气体体积增大的反应,因此达到平衡时,甲容器内的压强比乙容器内的大,其反应速l;,率快,又增大压强,平衡向逆反应方向移动,则甲容器中NH3的转化率比乙容器小。②向两容器中通入数量不多的等量氩气,甲容器体积不变,浓度不变,所以平衡不移动;乙容器压强不变,体积增大,反应混合物浓度减小,则平衡向正反应方向移动。③根据反应的特点,反应前后气体的物质的量的增加量就是分解的氨气的物质的量,设有x mol的氨气发生分解,则M=
N2(g)+3H2(g)是气体体积增大的反应,因此达到平衡时,甲容器内的压强比乙容器内的大,其反应速l;,率快,又增大压强,平衡向逆反应方向移动,则甲容器中NH3的转化率比乙容器小。②向两容器中通入数量不多的等量氩气,甲容器体积不变,浓度不变,所以平衡不移动;乙容器压强不变,体积增大,反应混合物浓度减小,则平衡向正反应方向移动。③根据反应的特点,反应前后气体的物质的量的增加量就是分解的氨气的物质的量,设有x mol的氨气发生分解,则M=![]() ,x=(
,x=(![]() -2) mol,则NH3的分解率为
-2) mol,则NH3的分解率为![]() ×100%=(
×100%=(![]() -1)×100%。
-1)×100%。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
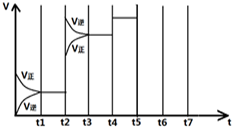 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( )
容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( )| A、该反应的x=3 | B、此条件下,该反应的平衡常数K=4 | C、给乙容器升温可缩短反应达平衡的时间也能提高平衡转化率 | D、其他条件不变,向甲容器中再充入0.2mol C,平衡时A的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源:志鸿系列训练必修一化学人教版 人教版 题型:022
A、B、C、D为中学化学中常见的四种气体单质.
(1)已知在空气中A约占21%、C约占78%(均为体积分数);D在标准状况下的密度为3.170 g·L-1.分别写出A、C、D的化学式:A________、C________、D________.SO2通入D的水溶液中,可以发生氧化还原反应,其化学方程式为:________.
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙.已知甲、乙分子中含有的电子数均与Na+相同;乙与丙可化合生成一种离子化合物.
甲、乙的化学式是:甲________、乙________;丙的电子式是:________.
(3)乙可以发生如下图所示一系列转化(无关物质及反应条件已略去):
单质A与化合物乙反应的化学方程式为________.
Z的稀溶液与过量铁粉反应,当反应中有1.806×1023个电子转移时,被还原的Z物质的量是________mol.
(4)将B、C按体积比为3∶1混合分别装入盛有催化剂的密闭容器Ⅰ和Ⅱ中(容积相同),若反应过程中容器Ⅰ保持温度和压强不变,容器Ⅱ保持温度和容积不变,当反应达平衡时,容器Ⅰ内气体的密度________容器Ⅱ内气体的密度(填“大小”“小于”或“等于”),理由是________.在容器Ⅰ中,当反应达平衡时容积变为起始时的![]() ,则C的转化率为________.
,则C的转化率为________.
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三上学期期末考试化学试卷 题型:填空题
(15分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ.有甲、乙两个容积相等的恒容密闭容器,
发生反应3A(g)+B(g)  xC(g)
△H = QKJ/mol
xC(g)
△H = QKJ/mol
回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号)
① 化学反应速率:v(A)=3v(B) ② 混合气体的密度保持不变
③ 有3molA消耗的同时有1molB生成 ④ C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q 0(填“大于”或“小于”)
(3)向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应3A(g)+B(g)  xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。
xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。
① 若平衡时,甲、乙两容器中A的物质的量相等,则x= ;
② 平衡时甲中A的体积分数为 ;
③ 若平衡时两容器的压强不相等,则两容器中压强之比为
Ⅱ.(1)pH=3的盐酸a L,分别与下列3种溶液混合,充分反应后溶液呈中性:
①pH=11的氨水b L; ②物质的量浓度为1×10-3 mol/L 氨水c L;
③c(OH-)=1×10-3 mol/L的Ba(OH)2溶液d L;
试判断a、b、c、d的大小关系正确的是
A.a=b>c>d B.b>a=d>c C.c>a>d>b D.c>a=d>b
(2)已知室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液, 两溶液中c(H+) • c(OH-)=___________;各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液;各取5mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(3)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH4+) 由大到小的顺序是: (填编号)。
Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。
(1)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是 ;
(2) 下列叙述不正确的是 (填字母)
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com