
控制合适的条件,将反应2Fe3++2I-  2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是
2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知2H→H2放出437.6kJ的热量,下列说法正确的是( )
A.氢气分子内每个氢原子都达到了8电子稳定结构
B.1mol H2离解成2mol H要放出437.6kJ热量
C.1mol H2的能量比2mol H的能量低 D.氢原子的活泼性比氢分子弱
查看答案和解析>>
科目:高中化学 来源: 题型:
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
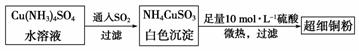
①NH4CuSO3中金属阳离子的核外电子排布式为 。N、O、S三种元素的第一电离能大小顺序为 (填元素符号)。
②Cu(NH3)4SO4中所含的化学键有
 (2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根
据等电子体原理,CO分子的结构式为 。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为
 (4) Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
(4) Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | H2Se -42.0 | H2Te -1.8 |
下列各项中正确的是( )
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)中和热的测定实验(如图)。
①量取反应物时,取50 mL 0.50 mol/L的盐酸,还应
加入的试剂是 (填序号)。
A.50 mL 0.50 mol/LNaOH溶液
B.50 mL 0. 55 mol/LNaOH溶液
C.1.0 g NaOH固体
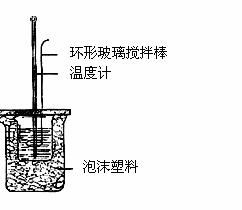
②在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度 B.盐酸的温度 C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度 E.水的比热容 F.反应后混合溶液的最高温度
③若用50 mL 0.50 mol/L的醋酸溶液代替上述盐酸测定中和热,所得数据 (填“偏大”或“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法中不正确的是
A.KIO3+6HI=KI+3H2O+3I2 ,生成3mol I2转移电子的总数为5NA
B.标准状况下,5.6 L氧气中含有O的总数为0.5NA
C.25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA
D.20 g重水(D2O)中所含电子总数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X 、Y 、Z 。
(2)X离子的结构示意图为 。X与Y形成的离子化合物的电子式为 , Z和氢形成的化合物的电子式为 。
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与水反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com