
 O2(g)=H2O(l) ΔH3=-285.8kJ?mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ?mol-1 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:2012-2013学年浙江宁波万里国际学校高一下学期期中考试化学试卷(带解析) 题型:填空题
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施。化学反应的焓变一般通过实验进行测定,也可进行理论推算。
(1)实验测得,0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量。写出上述燃烧反应的热化学方程式 。标准状况下11.2L乙硼烷完全燃烧生成液态水时放出的热量是 kJ。
(2)在化学反应过程中,拆开化学键需要吸收能量,形成化学键又会释放能量。已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗496kJ能量,形成水蒸气中的1mol H-O键能够释放463kJ能量。试说明反应2H2(g)+O2(g)=2H2O(g)中的能量变化。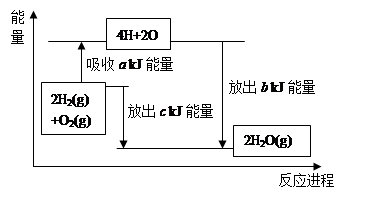
a= ,b= 。又知1mol液态水转化成气态水吸收44 kJ能量,则氢气完全燃烧生成液态水时的热化学方程式为 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧热分别如下:
①CH4(g)+2O2(g)=CO2(g)+2H2O ΔH1=-890.3 kJ?mol-1
②C(石墨)+O2(g)= CO2(g) ΔH2= —393.5 kJ?mol-1
③H2(g)+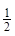 O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
④C(石墨)+2H2(g)= CH4(g) ΔH4
试根据盖斯定律求出石墨生成甲烷的反应热ΔH4= 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江宁波万里国际学校高一下学期期中考试化学试卷(解析版) 题型:填空题
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施。化学反应的焓变一般通过实验进行测定,也可进行理论推算。
(1)实验测得,0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量。写出上述燃烧反应的热化学方程式 。标准状况下11.2L乙硼烷完全燃烧生成液态水时放出的热量是 kJ。
(2)在化学反应过程中,拆开化学键需要吸收能量,形成化学键又会释放能量。已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗496kJ能量,形成水蒸气中的1mol H-O键能够释放463kJ能量。试说明反应2H2(g)+O2(g)=2H2O(g)中的能量变化。

a= ,b= 。又知1mol液态水转化成气态水吸收44 kJ能量,则氢气完全燃烧生成液态水时的热化学方程式为 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧热分别如下:
①CH4(g)+2O2(g)=CO2(g)+2H2O ΔH1=-890.3 kJ?mol-1
②C(石墨)+O2(g)= CO2(g) ΔH2= —393.5 kJ?mol-1
③H2(g)+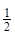 O2(g)=H2O(l)
ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l)
ΔH3= ─285.8 kJ?mol-1
④C(石墨)+2H2(g)= CH4(g) ΔH4
试根据盖斯定律求出石墨生成甲烷的反应热ΔH4= 。
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修4 1.1化学反应与能量的变化练习卷(解析版) 题型:计算题
实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出CH4、石墨和H2的燃烧热。试求出石墨生成甲烷的反应热。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.5kJ·mol-1;
C(石墨)+O2(g)= CO2(g) △H2=-393.5kJ·mol-1 ;
H2(g)+1/2O2(g)= H2O(l) △H3=-285.8kJ·mol-1。
求:C(石墨)+ 2H2(g)= CH4(g)△H4
查看答案和解析>>
科目:高中化学 来源:2012届北京市高二下期3月份月考化学试卷 题型:填空题
根据要求写出下列反应的热化学方程式
(1)一定量氢气与氯气反应生成氯化氢气体,当生成1mol氢氯键时放出91.5kJ的热量________________________________________________________.
(2)某化学反应的能量变化如图所示,该反应的热化学方程式是(反应热用abc表示)
_____________________________________________.
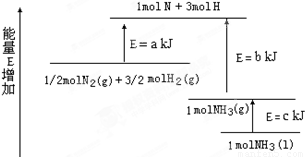
(3)某反应的平衡常数 如果有1molN2 完全反应,要吸收热量68kJ.写出该反应的热化学方程式______________________________________________.
如果有1molN2 完全反应,要吸收热量68kJ.写出该反应的热化学方程式______________________________________________.
(4)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol
C(石墨,s)+O2(g)=CO2(g) ;ΔH2=-393.5 kJ/mol
H2(g)+1/2O2(g)=H2O(l) ;△H3=-285.8 kJ/moL
则由石墨与氢气反应生成甲烷的热化学反应方程式为__________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com