
t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
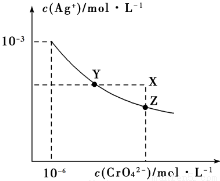
A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点
B.在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃
C.向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点
D.在t℃时,Ag2CrO4的Ksp为1×10-9
科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:选择题
现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:简答题
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某硫化锌精矿的主要成分为ZnS(还含少量 FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为____________________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极,阳极逸出的气体是___________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS)。请用简短的语言解释该反应发生的原理_______________________。
(7)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.按照系统命名法, 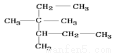 的名称为2,3—二甲基—2—乙基戊烷
的名称为2,3—二甲基—2—乙基戊烷
B.除去苯中 的方法:加溴水,充分振荡,静置分液。
的方法:加溴水,充分振荡,静置分液。
C.1mol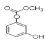 最多能与4mol氢氧化钠反应。
最多能与4mol氢氧化钠反应。
D.苯乙烯中所有原子不可能共平面
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:填空题
黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S═K2S+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的第一电离能从大到小依次为___________________________;
(2)生成物中,A 的电子式为____________;含极性共价键的分子的中心原子轨道杂化类型_____________;
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(4)S的基态原子价层电子排布式为___________,S的一种化合物ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0pm,密度为________g·cm3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________pm。

查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:选择题
设NA为阿伏加罗常数的值,下列说法正确的是( )
A.34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA
B.反应3H2(g)+N2(g) 2NH3(g) △H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA
2NH3(g) △H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA
C.常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数目无法计算
D.6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:选择题
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1 的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为16.4g
B.标准状况下产物NO的体积为22.4L
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.参加反应的硝酸的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:选择题
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是
A. X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B. Y的氢化物比R的氢化物稳定,熔沸点高
C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D. RY2、WY2通入Ba(NO3)2溶液中均无白色沉淀生成。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高二6月小班成果验收化学卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数小于3NA
B.0.1 mol Cl2完全溶于水,转移的电子数目为0.1NA
C.56g铁片投入足量浓H2SO4中生成NA个SO2分子
D.5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.25NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.25NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com