
下列说法中,正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C.生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的化学计量数无关
科目:高中化学 来源:2016-2017学年天津市武清区等五区县高二上期中化学卷(解析版) 题型:选择题
今有室温下有四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
PH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
A.分别加水稀释10倍,四种溶液的pH①>②>④>③
B.①加入适量的氯化铵晶体后,溶液的pH减小
C.①溶液中c(NH4+)+c(H+)大于④中的c(Cl-)+c(OH-)
D.VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实 验 | 用CCl4提取 溴水中的Br2 | 除去乙醇中的苯 | 从KI和I2的固体 混合物中回收I2 | 配制100 mL 0.1000 mol·L-1 K2Cr2O7溶液 |
装 置 或 仪 器 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:选择题
一定温度下,对于可逆反应A2(g)+3B2(g) 2AB3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是
2AB3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是
A.恒容容器内混合气体的密度不再变化
B.AB 3的生成速率与B2的生成速率之比为2∶3
C.恒压容器内混合气体的总物质的量不再变化
D.单位时间内断裂a mol A≡A键,同时断裂6a mol A—B键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:选择题
X、Y、Z、W有如下图所示的转化关系,且ΔH=ΔH1+ΔH2,则X、Y可能是

①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2
A.①②③④⑤ B.②④⑤ C.①③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上11月模拟化学卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法不正确的是
A. 原子半径大小顺序:r(Z)>r(W)>r(X) >r(Y)
B. Y分别与Z、W形成的化合物中化学键类型相同
C. X的最高价氧化物对应水化物的酸性比W的强
D. Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上月考三化学试卷(解析版) 题型:选择题
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并 产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
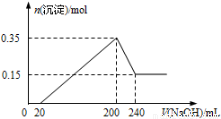
A.Mg和Al的总质量为8g
B.硫酸的物质的量浓度为5mol/L
C.NaOH溶液的物质的量浓度为5mol/L
D .生成的H2在标准状况下的体积为11.2L
.生成的H2在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高三上学期期中化学试卷(解析版) 题型:选择题
关于下列各图说法正确的是( )
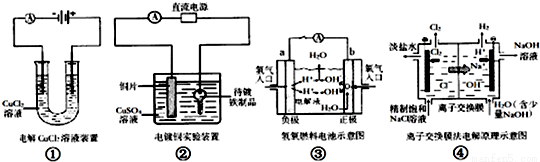
A、①中阴极处能产生使湿润的淀粉KI试纸变蓝的气体
B、②中待镀品应与电源的正极相连
C、③中电子由b极流向a极
D、④中离子反应交换膜可以避免氯气与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:填空题
I.工业上有一种用C02来生产甲醇燃料的方法:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
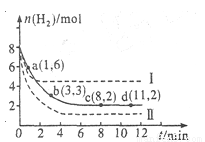
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。
(2)下列时间段平均反应速率最大的是 。
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线)。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变再充入3molCO2和4 mol H2,H2O(g)的体积分数 (填“增大”“不变”或“减小”)。
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 。
Ⅱ.工业上还可在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到 平衡状态的依据是 。
平衡状态的依据是 。
A.2v(H2)(逆)=v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓 度都不再发生变化
度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(2 )在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com