
| A. | 0.1 mol.L-1 NaOH溶液:K+、SO42-、CO32- | |
| B. | 0.1 mol.L-1 NaOH溶液:NH4+、Cl-、HCO3 - | |
| C. | PH=1的溶液中:Fe2+、NO3 -、Ba2+ | |
| D. | 0.1 mol.L-1 Na2CO3溶液:Ca2+、NO3 -、OH- |
分析 A.三种离子之间不发生反应,都不与氢氧化钠反应;
B.铵根离子、碳酸氢根离子与氢氧化钠反应;
C.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.碳酸钠与钙离子反应生成碳酸钙沉淀,钙离子与氢氧根离子反应生成微溶物氢氧化钙.
解答 解:A.K+、SO42-、CO32-之间不发生反应,都不与NaOH反应,在溶液中能够大量共存,故A正确;
B.NH4+、HCO3-与NaOH发生反应,在溶液中不能大量共存,故B错误;
C.该溶液为酸性溶液,Fe2+、NO3-之间在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Na2CO3、Ca2+反应生成难溶物碳酸钙,Ca2+、OH-之间反应生成微溶物氢氧化钙,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 近年来禽流感病毒H7N9时有病例报告,卫生部门强调要尽量避免接触活禽,个人也应加强消毒预防,其中消毒剂可以选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| B. | 将浸泡过高锰酸钾溶液的硅藻土放入新鲜的水果箱内是为了催熟水果 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 用二氧化碳制全降解塑料,可以缓解温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:3 | B. | 3:1:2 | C. | 2:6:3 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨的能量比金刚石低 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转化为石墨是物理变化 | D. | 金刚石比石墨更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
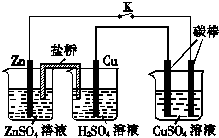
| A. | 铜棒为正极,其电极反应式为2H++2e-=H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为6.5 g | |
| D. | 导线中通过电子的物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com