
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅰ、Ⅱ、Ⅲ的化学平衡常数分别为K1、K2、K3、则K3=__________(用K的代数式表示)
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图 1 所示。

①比较 T1 与 T2 的大小关系:T1____________T2(填“<”、“=”或“>”)
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为________。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图 2所示(3~4 min 的浓度变化未表示出来),则改变的条件为 __________,请用 H2 的浓度变化计算从4 min开始到 A点的反应速率v(H2)= _________(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_______L
【答案】K3=K1χK2 < 4/27 或0.148 减小压强 0.08 mol·L-1·min-1 8/15 或0.533
【解析】
(1)根据化学平衡常数的定义进行分析;
(2)①由于正反应是放热反应,因此在压强相等时温度升高二氧化碳的转化率降低,所以根据图像可知T1<T2;
②根据三段式进行分析计算。
(1)根据化学平衡常数的定义,反应Ⅰ的化学平衡常数K1=[c(CO)c(H2O)]/[c(CO2)c(H2)],
反应Ⅱ的化学平衡常数K2=[c(CH3OH)]/[c(CO)c2(H2)] ,反应Ⅲ的化学平衡常数K3=
[c(CH3OH)c(H2O)]/[c(CO2)c3 (H2)],则K3=K1×K2,故答案为:K3=K1×K2。
(2)①由于正反应是放热反应,因此在压强相等时温度升高二氧化碳的转化率降低,所以根据图像可知T1<T2,故答案为:<。
②根据图像可知在T1和P6的条件下二氧化碳的转化率是40%,往密闭容器中充入3molH2和1molCO2,该反应在第5min时达到平衡,此时容器的体积为1.8L,则此时反应的二氧化碳是0.4mol,所以
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始量(mol)1 3 0 0
变化量(mol)0.4 1.2 0.4 0.4
平衡量(mol)0.6 1.8 0.4 0.4
所以平衡时二氧化碳、氢气、甲醇和水蒸气的浓度分别是(mol/L)1/3、1、2/9、2/9
因此该温度下,反应的平衡常数K=2/9×2/9÷1/3×13=4/27=0.148。
a.若此条件下反应至3min时刻,改变条件并于A点处达到平衡,CH3OH的浓度随反应时间的变化趋势如图2所示,此时需要的时间是6min>5min,这说明反应速率降低,因此改变的条件为降低压强,由图2可知,从4 min开始到 A点的反应速率v(CH3OH)=(0.21-0.15)mol/L/(6.3-4)min= 0.026 mol·L-1·min-1,由反应方程式v(H2):v(CH3OH)=3:1,故用 H2 的浓度变化计算从4 min开始到 A点的反应速率v(H2)= 0.08 mol·L-1·min-1,故答案为:减小压强,0.08 mol·L-1·min-1。
b.若温度不变,压强恒定在P8的条件下重新达到平衡时二氧化碳的转化率为60%,则
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始量(mol)1 3 0 0
变化量(mol)0.6 1.8 0.6 0.6
平衡量(mol)0.4 1.2 0.6 0.6
所以0.6/V×0.6/V÷0.4/V×(1.2/V)3=4/27
解得V=8/15L= 0.533L
故答案为:8/15或 0.533。


科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0,下列结论中不正确的是
pC(g)+qD(g) ΔH<0,下列结论中不正确的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D. 若温度不变时,在恒容条件下充入稀有气体增大压强,该反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
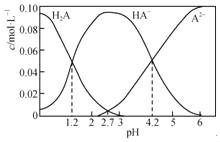
A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
(2)CO2可以被NaOH溶液捕获。
①若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
②当2molCO2通入3molNaOH被吸收时,溶液中离子浓度关系正确的是(选填字母)________。
a.c(Na+)+c(H+)=c(CO32)+c(HCO3-)+c(OH-)
b.c(Na+)>c(HCO3-)>c(CO32)> c(OH-)>c(H+)
c.3c(Na+)=2[c(CO32)+c(HCO3-) +c(H2CO3)]
(3)CO2辅助的CO—O2燃料电池,工作原理如图所示,固体介质中CO32— 可定向移动。电池的负极反应式:________________________________电池工作时需向某电极通入CO2以触发反应,该电极为_____________(填“甲”或“乙”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]可用于生产油漆、药物等。
(1)Fe2+的核外电子排布式为_____。
(2)CN﹣中C原子轨道的杂化类型为_____。与CN﹣互为等电子体的一种分子的结构式为_____。
(3)[Cu(H2O)4]2+结构示意图如图所示。[Fe(CN)6]4﹣结构示意图如图所示,请在图中相应位置补填配体_________。

(4)已知3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
(5)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着局部示意如图所示。则铁表面上氮原子与铁原子的数目比为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为_____________;氧原子个数之比为____________。
(2)在标准状况下,6.8g PH3与标准状况下_______L CH4含有相同数目的H原子。
(3)某气体氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
(4)273 K、1.01×105 Pa时气态单质X2的密度为1.25 g·L-1,则X的相对原子质量为________
(5)相同温度和压强条件下,一定体积的气态氢化物H2R的质量是等体积NH3的2倍,则R的相对原子质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列转化过程的化学方程式。单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
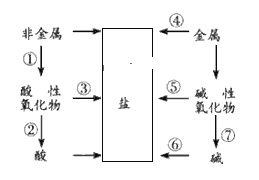
①______,②_______,③_______,④________,⑤____,⑥_______,⑦______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
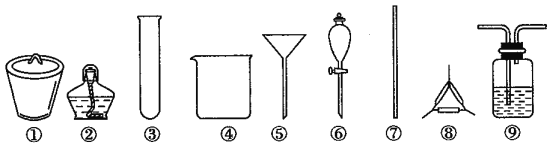
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1二元酸H2A溶液中滴加0.2 mol·L-l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
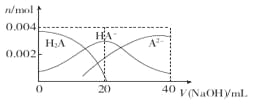
A. 当V(NaOH)="20" mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c( A2-)>c( OH-)> ((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH) ="40" mL时,升高温度,c(Na+)/c(A2-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com