
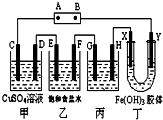
 æĪĢāŹ½ŃŠ¾æŠŌѧĻ°ŹĒÅąŃųѧɜ““ŌģĖ¼Ī¬µÄĮ¼ŗĆ·½·Ø£¬Ä³ŃŠ¾æŠŌѧĻ°Š”×齫ĻĀĮŠ×°ÖĆČēĶ¼Į¬½Ó£¬C”¢D”¢E”¢F”¢X”¢Y ¶¼ŹĒ¶čŠŌµē¼«£®½«µēŌ“½ÓĶØŗó£¬ĻņŅŅÖŠµĪČė·ÓĢŖŹŌŅŗ£¬ŌŚF¼«ø½½üĻŌŗģÉ«£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
æĪĢāŹ½ŃŠ¾æŠŌѧĻ°ŹĒÅąŃųѧɜ““ŌģĖ¼Ī¬µÄĮ¼ŗĆ·½·Ø£¬Ä³ŃŠ¾æŠŌѧĻ°Š”×齫ĻĀĮŠ×°ÖĆČēĶ¼Į¬½Ó£¬C”¢D”¢E”¢F”¢X”¢Y ¶¼ŹĒ¶čŠŌµē¼«£®½«µēŌ“½ÓĶØŗó£¬ĻņŅŅÖŠµĪČė·ÓĢŖŹŌŅŗ£¬ŌŚF¼«ø½½üĻŌŗģÉ«£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ·ÖĪö ½«µēŌ“½ÓĶØŗó£¬ĻņŅŅÖŠµĪČė·ÓĢŖŹŌŅŗ£¬ŌŚF¼«ø½½üĻŌŗģÉ«£¬ĖµĆ÷F¼«Éś³ÉOH-£¬FĪŖŅõ¼«£¬ŌņæÉÖŖAĪŖÕż¼«£¬BĪŖøŗ¼«£¬C”¢E”¢G”¢XĪŖŃō¼«£¬D”¢F”¢H”¢YĪŖŅõ¼«£¬
£Ø1£©µē½ā±„ŗĶŹ³ŃĪĖ®Ź±£¬·ÓĢŖ±äŗģµÄ¼«ŹĒŅõ¼«£¬Ņõ¼«ŗĶµēŌ“øŗ¼«ĻąĮ¬£»
£Ø2£©µē½āĮņĖįĶČÜŅŗÉś³ÉĮņĖį”¢ĶŗĶŃõĘų£»
£Ø3£©FĪŖŅõ¼«£¬Éś³ÉĒāĘų£»
£Ø4£©µē½ā¾«Į¶ĶŹ±£¬“ÖĶ×÷Ńō¼«£¬“æĶ×÷Ņõ¼«£¬ŗ¬ÓŠĶĄė×ÓµÄŃĪ×÷µē½āÖŹ£»
£Ø5£©ĒāŃõ»ÆĢś½ŗĮ£“ųÕżµēŗÉ£¬ĻņŅõ¼«ŅĘ¶Æ£®
½ā“š ½ā£ŗ½«µēŌ“½ÓĶØŗó£¬ĻņŅŅÖŠµĪČė·ÓĢŖŹŌŅŗ£¬ŌŚF¼«ø½½üĻŌŗģÉ«£¬ĖµĆ÷F¼«Éś³ÉOH-£¬FĪŖŅõ¼«£¬ŌņæÉÖŖAĪŖÕż¼«£¬BĪŖøŗ¼«£¬C”¢E”¢G”¢XĪŖŃō¼«£¬D”¢F”¢H”¢YĪŖŅõ¼«£¬
£Ø1£©ÓÉŅŌÉĻ·ÖĪöæÉÖŖAŹĒµēŌ“µÄÕż¼«£¬BŹĒŌµē³ŲµÄøŗ¼«£¬¹Ź“š°øĪŖ£ŗÕż¼«£»
£Ø2£©µē½āĮņĖįĶČÜŅŗÉś³ÉĮņĖį”¢ĶŗĶŃõĘų£¬µē½ā·½³ĢŹ½ĪŖ2CuSO4+2H2O$\frac{\underline{\;µē½ā\;}}{\;}$2Cu+O2”ü+H2SO4£¬¹Ź“š°øĪŖ£ŗ2CuSO4+2H2O$\frac{\underline{\;µē½ā\;}}{\;}$2Cu+O2”ü+H2SO4£»
£Ø3£©FĪŖŅõ¼«£¬Éś³ÉĒāĘųµē¼«·½³ĢŹ½ĪŖ2H2O+2e-=H2”ü+2OH-£¬¹Ź“š°øĪŖ£ŗ2H2O+2e-=H2”ü+2OH-£»
£Ø4£©µē½ā¾«Į¶ĶŹ±£¬“ÖĶ×÷Ńō¼«£¬“æĶ×÷Ņõ¼«£¬ŗ¬ÓŠĶĄė×ÓµÄŃĪ×÷µē½āÖŹ¼“æÉ£¬¹Ź“š°øĪŖ£ŗ“ÖĶ£»CuSO4£»
£Ø5£©øł¾ŻŅģŠŌµēŗÉĻąĪüµÄŌĄķ£¬ĒāŃõ»ÆĢś½ŗĢåÖŠŗ¬ÓŠµÄ“ųÕżµēŗɵÄĮ£×Ó»įĻņŅõ¼«¼“Y¼«ŅĘ¶Æ£¬ĖłŅŌY¼«ø½½üŗģŗÖÉ«±äÉī£¬¹Ź“š°øĪŖ£ŗY¼«ø½½üŗģŗÖÉ«±äÉī£®
µćĘĄ ±¾Ģāæ¼²éµē½āŌĄķ£¬Éę¼°µē½āŗĶµē¶Ę£¬ÕżČ·ÅŠ¶ĻÕżøŗ¼«¼°ŅõŃō¼«ŹĒ½ā±¾Ģā¹Ų¼ü£¬ÖŖµĄø÷øöµē¼«ÉĻ·¢ÉśµÄ·“Ó¦£¬»įÕżČ·ŹéŠ“µē¼«·“Ó¦Ź½£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗž±±Ź”øßČżĮŖŗĻæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹ŲŹµŃéµÄ²Ł×÷ÕżČ·µÄŹĒ
Ń”Ļī | ŹµŃéÄæµÄ | ŹµŃé²Ł×÷ |
A | ¼ģŃé¼ŲĄė×Ó | ²¬ĖæÕŗČ”ŹŌŃłŌŚ»šŃęÉĻ×ĘÉÕ£¬Ö±½Ó¹Ū²ģ»šŃęŃÕÉ« |
B | ³żČ„FeCl2ČÜŅŗÖŠ»ģÓŠµÄFeCl3 | ¼ÓČė×ćĮæĢś·Ū£¬½Į°č”¢¾²ÖĆ”¢¹żĀĖ |
C | ÖʱøFe(OH)3½ŗĢå | ±„ŗĶFeCl3ČÜŅŗµĪČėČȵÄNaOHČÜŅŗÖŠ |
D | ÓƱ½ŻĶČ”äåĖ®ÖŠµÄäå | ĻČ“Ó·ÖŅŗĀ©¶·ĻĀæŚ·Å³öĖ®²ć£¬ŌŁ·Å³öÓŠ»ś²ć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČÓŚ15% | B£® | “óÓŚ15% | C£® | Š”ÓŚ15% | D£® | ĪŽ·Ø¹ĄĖć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ČēĶ¼·“Ó¦£ŗČōp1£¾p2£¬Ōņ“Ė·“Ó¦Ö»ÄÜŌŚøßĪĀĻĀ×Ō·¢½ųŠŠ | |
| B£® | 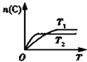 ČēĶ¼·“Ó¦£ŗ“Ė·“Ó¦µÄ”÷H£¼0£¬ĒŅT1£¼T2 | |
| C£® | 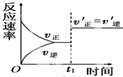 ČēĶ¼·“Ó¦£ŗ±ķŹ¾t1Ź±æĢŅ»¶ØŹĒŹ¹ÓĆ“ß»Æ¼Į¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ | |
| D£® | 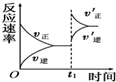 ČēĶ¼·“Ó¦£ŗ±ķŹ¾t1Ź±æĢŌö“óBµÄÅØ¶Č¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{1}{2}$lg£Ø$\frac{b}{a}$£© | B£® | $\frac{1}{2}$lg£Ø$\frac{a}{b}$£© | C£® | 14+$\frac{1}{2}$lg£Ø$\frac{a}{b}$£© | D£® | 14+$\frac{1}{2}$lg£Ø$\frac{b}{a}$£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
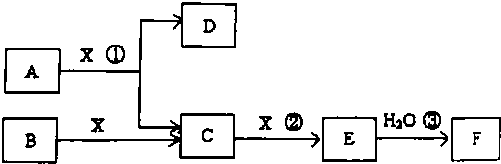
 £»
£»²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com