
| A. | 1 L溶液中含Ba2+、N${O}_{3}^{-}$的总数是0.6NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中N${O}_{3}^{-}$的浓度是0.2 mol•L-1 | |
| D. | 1 L溶液中含有0.4NA个N${O}_{3}^{-}$ |
分析 依据n=CV计算硝酸钡的物质的量,结合硝酸钡电离生成钡离子和硝酸根离子,溶液具有均一性,据此解答.
解答 解:A.1 L0.2 mol•L-1Ba(NO3)2溶液含有硝酸钡物质的量为1L×0.2mol/L=0.2mol,含有钡离子0.2mol,含有硝酸根离子0.4mol,含Ba2+、NO3-的总数是0.6NA,故A正确;
B.0.2 mol•L-1Ba(NO3)2溶液中钡离子浓度为0.2mol/L,溶液具有均一性,与体积无关,所以500 mL溶液中Ba2+的浓度是0.2 mol•L-1,故B正确;
C.1mol硝酸钡含有2mol 硝酸根离子,0.2 mol•L-1Ba(NO3)2溶液,硝酸根离子浓度为0.4mol/L,故C错误;
D.0.2 mol•L-1Ba(NO3)2溶液,硝酸根离子浓度为0.4mol/L,1 L溶液中含有0.4NA个NO3-,故D正确;
故选:C.
点评 本题考查了有关物质的量浓度计算,明确物质的量浓度定义及硝酸钡结构是解题关键,题目难度不大,注意溶液的均一性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在1 L 2 mol•L-1的硝酸镁溶液中含有的硝酸根离子数为2NA | |
| B. | 2.3 g Na变成Na+时失去的电子数目为0.2NA | |
| C. | 1 mol H2O的质量与NA个H2O的质量之和相等 | |
| D. | 在通常状况下,22.4 L O2与N2的混合物所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑥⑦ | C. | ②③④⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
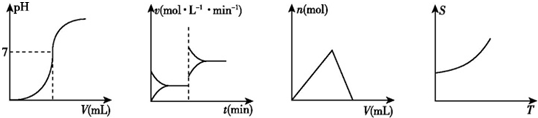
| A. | ①②③④ | B. | ②①③④ | C. | ③②②① | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
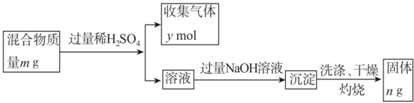
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
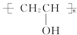 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$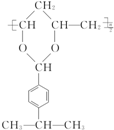
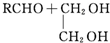 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$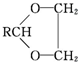 +H2O
+H2O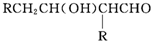 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$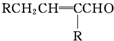
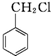 $\stackrel{K_{2}Cr_{2}O_{7}-KOH}{→}$
$\stackrel{K_{2}Cr_{2}O_{7}-KOH}{→}$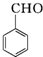
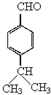 ,E中含有的官能团名称为羟基、醛基.
,E中含有的官能团名称为羟基、醛基.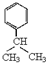 .
.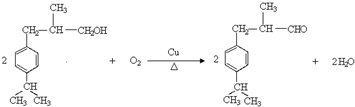 .
. .
.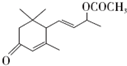 是否互为同分异构体否(填“是”或“否”),符合下列条件的
是否互为同分异构体否(填“是”或“否”),符合下列条件的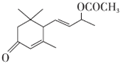 的同分异构体有2种,写出其中一种的结构简式
的同分异构体有2种,写出其中一种的结构简式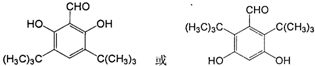 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa与O2在一定条件下生成Na2O和Na2O2混合物时,失去电子数为0.2NA | |
| B. | 50mL 12mol•L-1浓盐酸与足量二氧化锰加热反应,生成Cl2的分子数为0.15NA | |
| C. | 常温下,100mL 1mol•L-1Na2CO3溶液中阴离子总数等于0.1NA | |
| D. | 标准状况下,6.72LCO2中所含的共用电子对数为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 式量为30的碳、氢、氧组成的化合物无同分异构体 | |
| B. | 式量为128的烃的分子式不一定是C9H20 | |
| C. | 烃的式量可以是偶数,也可以是奇数 | |
| D. | 有机物分子中,H原子数可以是偶数,也可以是奇数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
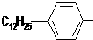
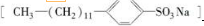 是常用洗涤剂的主要成分.
是常用洗涤剂的主要成分.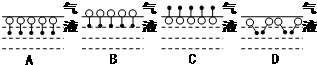
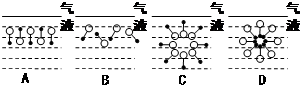
 .
.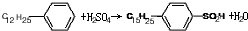 ,反应类型为取代反应.
,反应类型为取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com