
分析 (1)在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能达到的化合物为非电解质;在水溶液中能够完全电离的化合物为强电解质,部分电离的为弱电解质;单质和混合物既不是电解质,也不是非电解质,据此进行判断.
(2)能溶于水,且水溶液能导电的是水溶液中电离出了自由移动的离子.
解答 解:(1)在水溶液和熔融状态下都不导电的化合物为非电解质B.C2H5OH(l)、H.蔗糖(s)为非电解质;
强电解质为在水溶液中完全电离的化合物,满足条件的为A.KI(s)、E.BaSO4(s)、F.NaHSO4(s)、I.NaOH(l);
在水溶液中部分电离的电解质为弱电解质,满足条件的为D.CH3COOH(l);
故答案为:BH;AEFI;D;
(2)能溶于水,且水溶液能导电的是,A.KI(s)溶于水电离出离子导电,C.Cl2(g)溶于水生成盐酸和次氯酸,溶液导电,D.CH3COOH(l)溶于水部分电离出离子导电,F.NaHSO4(s)溶于水完全电离出离子,溶液导电,I.NaOH(l)溶于水完全电离,溶液导电,
故答案为:ACDFI.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的概念,题目难度不大,注意掌握强弱电解质、电解质与非电解质的概念及判断方法,明确无论电解质还是非电解质,都一定为化合物,溶液导电性是存在自由移动的离子.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3 KOH Na2CO3 O2 | B. | NaHCO3Ba(OH)2 NaCl Zn | ||
| C. | H2SO4 Na2O MgCl2 C | D. | HCl KOH Na2CO3 SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③⑤ | C. | 仅有⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
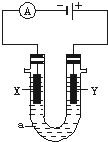 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com